Теоретические представления о строении растворов электролитов впервые были сформулированы в теории электролитической диссоциации Аррениуса.
1. Электролитами называются вещества, которые при растворении в соответствующих растворителях (например, вода) распадаются (диссоциируют) на ионы. Процесс называется электролитической диссоциацией. Ионы в растворе представляют собой заряженные частицы, которые ведут себя подобно молекулам идеального газа, то есть не взаимодействуют друг с другом.
2. Не все молекулы распадаются на ионы, а только некоторая доля α, которая называется степенью диссоциации:
 , (2.1)
, (2.1)
где  – количество распавшихся молекул;
– количество распавшихся молекул;  – общее количество молекул растворенного вещества.
– общее количество молекул растворенного вещества.
3. К процессу электролитической диссоциации применим закон действующих масс. Например, если в результате диссоциации слабого электролита получается
 , (2.2)
, (2.2)
то равновесная концентрация ионов  , а концентрация молекул, не распавшихся на ионы
, а концентрация молекул, не распавшихся на ионы  (
(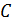 – исходная молярная концентрация вещества).
– исходная молярная концентрация вещества).
Константа диссоциации записывается следующим образом:
 , (2.3)
, (2.3)
где  – концентрация, которая в электрохимии и физической химии принята за стандарт,
– концентрация, которая в электрохимии и физической химии принята за стандарт,  моль/л
моль/л  моль/м3.
моль/м3.
Теория Аррениуса позволила рассчитать ряд важных свойств растворов электролитов.
Водородный показатель ( ) растворов электролитов:
) растворов электролитов:
 , (2.4)
, (2.4)
где  – концентрация ионов водорода в растворе.
– концентрация ионов водорода в растворе.
Для сильных кислот 
 . (2.5)
. (2.5)
 определяется исходной концентрацией кислоты
определяется исходной концентрацией кислоты 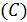 .
.
Для слабых кислот 
 , и выражение для константы диссоциации можно упростить:
, и выражение для константы диссоциации можно упростить:
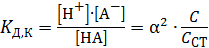 . (2.6)
. (2.6)
После совместного решения (2.4) и (2.6) получается выражение, из которого следует, что водородный показатель раствора слабой кислоты зависит от константы диссоциации этой кислоты:
 . (2.7)
. (2.7)
Водородный показатель слабого основания зависит от константы диссоциации основания:
 , (2.8)
, (2.8)
где  – ионное произведение воды,
– ионное произведение воды,  при 25 0С.
при 25 0С.
Водородный показатель кислот средней силы:
 . (2.9)
. (2.9)
При обработке экспериментальных данных может быть использовано другое представление:
 . (2.10)
. (2.10)
Многие соли в водных растворах подвергаются гидролизу, поэтому  растворов таких солей может быть в кислой или щелочной области. Например, водородный показатель раствора соли
растворов таких солей может быть в кислой или щелочной области. Например, водородный показатель раствора соли  , образованной слабым основанием
, образованной слабым основанием  и сильной кислотой
и сильной кислотой 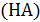 , зависит от произведения растворимости слабого основания
, зависит от произведения растворимости слабого основания  :
:
 , (2.11)
, (2.11)
где  – кислотность основания.
– кислотность основания.
Буферными свойствами обладают растворы слабых кислот и их солей с сильными основаниями или слабые основания и соли, образованные этими основаниями и сильными кислотами.
Буферную смесь можно приготовить, добавляя к раствору слабой кислоты  (исходная концентрация
(исходная концентрация 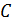 ) раствор щелочи
) раствор щелочи 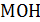 . Щелочь вводят в раствор в таком количестве, чтобы ее расчетная концентрация в получившемся растворе стала
. Щелочь вводят в раствор в таком количестве, чтобы ее расчетная концентрация в получившемся растворе стала  . Поскольку слабая кислота прореагирует со щелочью
. Поскольку слабая кислота прореагирует со щелочью
 , (2.12)
, (2.12)
то в растворе образуется соль, концентрация которой равна концентрации щелочи  .
.
При этом концентрация молекул слабой кислоты, не распавшихся на ионы, будет  . Водородный показатель такой буферной смеси:
. Водородный показатель такой буферной смеси:
 . (2.13)
. (2.13)
Буферная емкость раствора  – количество щелочи, которое необходимо добавить для изменения
– количество щелочи, которое необходимо добавить для изменения  буферного раствора на единицу:
буферного раствора на единицу:
 . (2.14)
. (2.14)
Буферная емкость максимальна, если концентрация добавляемой щелочи в 2 раза меньше концентрации слабой кислоты.
Если буферная смесь приготовлена смешением соли и слабой кислоты, концентрации которых в буферной смеси равны соответственно  и
и  , то водородный показатель
, то водородный показатель
 . (2.15)
. (2.15)
Все приведенные выше соотношения, связывающие  с концентрацией электролита, основаны на теории электролитической диссоциации Аррениуса, которая не учитывает электростатическое взаимодействие между ионами. Поэтому, при выполнении высокоточных измерений, вместо концентрации следует использовать активности электролитов. Детальный анализ метрологических тонкостей таких измерений можно найти в монографии Р. Робинсона, Р. Стокса [2].
с концентрацией электролита, основаны на теории электролитической диссоциации Аррениуса, которая не учитывает электростатическое взаимодействие между ионами. Поэтому, при выполнении высокоточных измерений, вместо концентрации следует использовать активности электролитов. Детальный анализ метрологических тонкостей таких измерений можно найти в монографии Р. Робинсона, Р. Стокса [2].
Лабораторная работа №1.
Определение  раствора слабой кислоты
раствора слабой кислоты
Согласно теории Аррениуса электролиты в растворе диссоциируют на ионы. Слабые электролиты диссоциируют не полностью:
 . (2.16)
. (2.16)
Полнота протекания этого процесса определяется степенью диссоциации  . При исходной концентрации кислоты
. При исходной концентрации кислоты 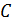 образуется
образуется  ионов
ионов  и такое же количество анионов
и такое же количество анионов  , а количество недиссоциированных молекул, которые остались в растворе составляет
, а количество недиссоциированных молекул, которые остались в растворе составляет  . Таким образом, константа диссоциации может быть описана выражением (2.3).
. Таким образом, константа диссоциации может быть описана выражением (2.3).
 .
.
Соотношение (2.3) позволяет получить выражение для расчета степени диссоциации слабой кислоты. Если значение  много меньше единицы, то знаменатель в выражении (2.3) примерно равен 1. Тогда из уравнения (2.6) можно получить выражение для степени диссоциации
много меньше единицы, то знаменатель в выражении (2.3) примерно равен 1. Тогда из уравнения (2.6) можно получить выражение для степени диссоциации
 . (2.17)
. (2.17)
Теперь легко определить концентрацию ионов водорода:
 , (2.18)
, (2.18)
и значение  раствора:
раствора:
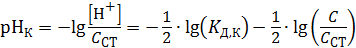 . (2.19)
. (2.19)
В расчетах удобно пользоваться размерностью концентрации моль/л, так как стандартное значение концентрации в этой шкале равно единице, тогда можно записать уравнение (2.19) в более простом виде
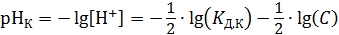 .
.
Уравнение (2.19) в полулогарифмических координатах  представляет собой прямолинейную зависимость.
представляет собой прямолинейную зависимость.
Цель работы – установить зависимость  раствора слабой кислоты от концентрации и определить значение константы диссоциации.
раствора слабой кислоты от концентрации и определить значение константы диссоциации.
Экспериментальная часть
Объектом исследования является уксусная кислота, исходный раствор которой содержит 1 моль/л HAc. Путем разбавления необходимо приготовить 6 растворов с разной заданной концентрацией кислоты и заданного объема. Рассчитав необходимые для приготовления нужного раствора объемы уксусной кислоты и воды, отбирают эти жидкости в нужном количестве с помощью мерной посуды – бюреток.
Величину  раствора измеряют, используя стеклянный электрод. Отодвинув поворотом в горизонтальной плоскости подставку под стаканчик с водой, заменяют его на стакан с исследуемым раствором и опускают в него датчик стеклянного электрода. Измерения проводят не менее 3 раз, заменяя каждый раз порцию раствора.
раствора измеряют, используя стеклянный электрод. Отодвинув поворотом в горизонтальной плоскости подставку под стаканчик с водой, заменяют его на стакан с исследуемым раствором и опускают в него датчик стеклянного электрода. Измерения проводят не менее 3 раз, заменяя каждый раз порцию раствора.