Процесс образования ионов и устойчивость растворов электролитов (ионных систем) невозможно объяснить без учета сил взаимодействия между ионами и молекулами растворителя (ион-дипольное взаимодействие) и ион-ионного взаимодействия. Всю совокупность взаимодействий можно формально описать, используя вместо концентраций  активности ионов
активности ионов 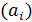 :
:
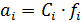 , (4.1)
, (4.1)
где 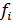 – коэффициент активности i -го сорта ионов.
– коэффициент активности i -го сорта ионов.
При описании свойств растворов электролитов используют понятия активности соли
 (4.2)
(4.2)
и средней ионной активности
 , (4.3)
, (4.3)
где 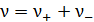 , а
, а  и
и  – стехиометрические коэффициенты катиона и аниона соответственно;
– стехиометрические коэффициенты катиона и аниона соответственно; 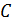 – молярная концентрация растворенного вещества;
– молярная концентрация растворенного вещества; 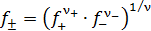 – средний коэффициент активности.
– средний коэффициент активности.
В теории сильных электролитов Дебая и Гюккеля при определении коэффициентов активности рассматриваются два приближения [1, 2].
В первом приближении при выводе выражения для среднего коэффициента активности предполагается, что ионы представляют собой математические точки (размер иона 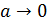 ) и между ними действуют силы электростатического взаимодействия:
) и между ними действуют силы электростатического взаимодействия:
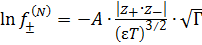 , (4.4)
, (4.4)
где  – коэффициент активности в рациональной шкале (
– коэффициент активности в рациональной шкале ( – концентрация, выраженная в мольных долях);
– концентрация, выраженная в мольных долях); 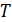 – температура;
– температура; 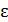 – диэлектрическая проницаемость среды (растворителя);
– диэлектрическая проницаемость среды (растворителя);
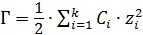 – ионная сила раствора, моль/л,
– ионная сила раствора, моль/л,  – количество видов ионов в растворе;
– количество видов ионов в растворе;
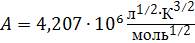 .
.
Расчет среднего коэффициента активности по первому приближению справедлив для разбавленных растворов сильных электролитов.
Во втором приближении Дебай и Гюккель учли, что ионы имеют конечный размер, константа a имеет смысл расстояния между центрами соседних ионов. В результате теплового движения ионы в растворе электролита располагаются вокруг иона, произвольно выбранного за центральный, в виде сферы. Все ионы раствора равноценны: каждый окружен ионной атмосферой и, в то же время, каждый центральный ион входит в состав ионной атмосферы другого иона. Гипотетическая ионная атмосфера имеет равный по величине и противоположный по знаку заряд относительно заряда центрального иона. Радиус ионной атмосферы обозначают как  . Выражение для среднего коэффициента активности по второму приближению Дебая и Гюккеля имеет вид
. Выражение для среднего коэффициента активности по второму приближению Дебая и Гюккеля имеет вид
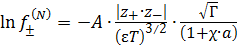 , (4.5)
, (4.5)
где  ,
, 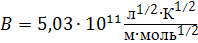 .
.
При погружении металла в раствор, содержащий ионы этого же металла, начинается обмен между ионами кристаллической решетки металла и ионами металла в растворе электролита. В результате на поверхности металла и в слое электролита, непосредственно прилегающем к поверхности металла, накапливаются заряженные частицы противоположного знака. Наличие пространственно разделенных электрических зарядов приводит к возникновению скачка потенциалов. Состояние, когда скорости процессов обмена ионами между металлом и раствором становятся равны, характеризует равновесие, а скачок потенциала, соответствующий этому состоянию, называется равновесным гальвани-потенциалом. Измерить отдельно взятый гальвани-потенциал невозможно. Электродные потенциалы определяют по величине эдс, измеренной относительно электродов сравнения, в качестве которых используют водородный, хлоридсеребряный, каломельный, ртутно-сульфатный и другие электроды. Для этого составляют электрохимическую цепь, состоящую из исследуемого электрода и электрода сравнения, которые соединяются электролитическим ключом, заполненным раствором электролита. Измерения проводят в условиях равновесия (в отсутствие внешнего тока) с помощью высокоомного вольтметра.
Зависимость равновесного потенциала от состава раствора описывает уравнение Нернста
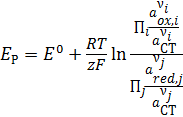 , (4.6)
, (4.6)
где  – активность компонентов электролита, находящихся в окисленной форме;
– активность компонентов электролита, находящихся в окисленной форме;
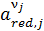 – активность компонентов электролита, находящихся в восстановленной форме;
– активность компонентов электролита, находящихся в восстановленной форме;
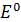 – стандартный электродный потенциал соответствует потенциалу, измеренному в стандартных условиях (
– стандартный электродный потенциал соответствует потенциалу, измеренному в стандартных условиях (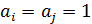 моль/л) относительно нормального водородного электрода, условно принятого за ноль при любой температуре.
моль/л) относительно нормального водородного электрода, условно принятого за ноль при любой температуре.
Наиболее удобный и точный метод измерения  – потенциометрический. Он основан на измерении ЭДС элемента, в котором одним из электродов является индикаторный электрод, а вторым – электрод сравнения. Индикаторными называются электроды, обратимые относительно ионов определенного сорта; в данном случае – относительно катионов водорода:
– потенциометрический. Он основан на измерении ЭДС элемента, в котором одним из электродов является индикаторный электрод, а вторым – электрод сравнения. Индикаторными называются электроды, обратимые относительно ионов определенного сорта; в данном случае – относительно катионов водорода:
 . (4.7)
. (4.7)
Они используются для измерения водородного показателя ( ) растворов электролитов.
) растворов электролитов.
К наиболее распространенным индикаторным электродам относятся:
- водородный 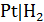 , исследуемый раствор;
, исследуемый раствор;
- хингидронный  , исследуемый раствор;
, исследуемый раствор;
- сурьмянооксидный  , исследуемый раствор.
, исследуемый раствор.
- стеклянный – на границе стекло-раствор возникает ЭДС, величина которой связана с  исследуемого раствора.
исследуемого раствора.
Лабораторная работа 10. Определение рН электролита
с помощью стеклянного и хингидронного
индикаторных электродов
Хингидронный индикаторный электрод относится к классу окислительно-восстановительных электродов и представляет собой гладкую платиновую пластинку, погруженную в исследуемый раствор, насыщенный хингидроном 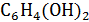 . Хингидрон распадается в растворе на эквивалентные количества хинона и гидрохинона. В результате устанавливается равновесие:
. Хингидрон распадается в растворе на эквивалентные количества хинона и гидрохинона. В результате устанавливается равновесие:
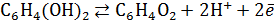 .(4.8)
.(4.8)
В соответствии с уравнением Нернста потенциал хингидронного электрода зависит от активности катионов водорода
 . (4.9)
. (4.9)
В условиях равновесия активности хинона и гидрохинона равны
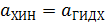 , поэтому
, поэтому
 . (4.10)
. (4.10)
Стандартный потенциал хингидронного электрода с учетом влияния температуры равен  .
.
Хингидронный электрод неприменим в щелочных растворах (при 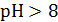 ). Причина состоит в том, что в результате диссоциации активность гидрохинона снижается и отношение
). Причина состоит в том, что в результате диссоциации активность гидрохинона снижается и отношение 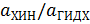 становится не равно единице. Кроме того, в сильно щелочных растворах хинон химически разлагается. В концентрированных растворах нейтральных солей хингидронный электрод дает ошибку порядка
становится не равно единице. Кроме того, в сильно щелочных растворах хинон химически разлагается. В концентрированных растворах нейтральных солей хингидронный электрод дает ошибку порядка  вследствие неодинаковой активности хинона и гидрохинона. Ошибки возникают в присутствии окислителей и восстановителей (
вследствие неодинаковой активности хинона и гидрохинона. Ошибки возникают в присутствии окислителей и восстановителей ( ,
, 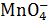 ,
,  и др.), которые химически взаимодействуют с хиноном либо с гидрохиноном.
и др.), которые химически взаимодействуют с хиноном либо с гидрохиноном.
Хингидронный электрод можно применять во всех растворах, где применим водородный электрод и, кроме того, в растворах солей металлов, более благородных, чем водород, алколоидов, растворов ненасыщенных кислот, в присутствии разбавленной азотной кислоты, ее солей и т. п.
Стеклянный электрод – один из самых надежных и точных индикаторных электродов. Стеклянная трубка оканчивается тонким стеклянным шариком. Внутри шарика залит стандартный раствор с определенным значением  , в который погружен металлический электрод. Часто применяют
, в который погружен металлический электрод. Часто применяют 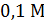 раствор соляной кислоты и серебряный электрод, покрытый слоем хлорида серебра.
раствор соляной кислоты и серебряный электрод, покрытый слоем хлорида серебра.
Стеклянный электрод опускают в раствор,  которого требуется определить, и измеряют потенциал этого электрода относительно хлоридсеребряного (или каломельного) электрода сравнения. Общая схема цепи выглядит следующим образом:
которого требуется определить, и измеряют потенциал этого электрода относительно хлоридсеребряного (или каломельного) электрода сравнения. Общая схема цепи выглядит следующим образом:
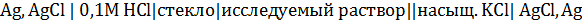
При не слишком больших  разность потенциалов цепи со стеклянным электродом равна:
разность потенциалов цепи со стеклянным электродом равна:
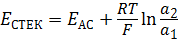 , (4.11)
, (4.11)
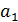 – активность ионов водорода во внутреннем растворе и
– активность ионов водорода во внутреннем растворе и 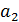 – активность ионов водорода в исследуемом растворе;
– активность ионов водорода в исследуемом растворе;  – потенциал асимметрии. Потенциал асимметрии равен разности потенциалов на концах цепи, в которой растворы с внутренней и внешней сторон стеклянного шарика одинаковы:
– потенциал асимметрии. Потенциал асимметрии равен разности потенциалов на концах цепи, в которой растворы с внутренней и внешней сторон стеклянного шарика одинаковы:
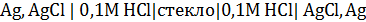 .
.
Потенциал асимметрии обусловлен различием в свойствах внутренней и внешней поверхностей стеклянного шарика. Его величина не превышает нескольких милливольт и зависит от состава стекла и способа изготовления шарика.
Так как активность ионов водорода во внутреннем растворе сохраняется постоянной, то уравнение можно преобразовать:
 , (4.12)
, (4.12)
где  – стандартный для данного электрода потенциал, который может быть определен калибровкой электрода при помощи растворов с известными значениями
– стандартный для данного электрода потенциал, который может быть определен калибровкой электрода при помощи растворов с известными значениями  . Уравнение (4.12) справедливо для кислых, нейтральных и слабощелочных растворов. При больших
. Уравнение (4.12) справедливо для кислых, нейтральных и слабощелочных растворов. При больших  наблюдаются отклонения от этого уравнения (щелочная ошибка стеклянного электрода), значения которых зависят от сорта стекла, природы катионов раствора и
наблюдаются отклонения от этого уравнения (щелочная ошибка стеклянного электрода), значения которых зависят от сорта стекла, природы катионов раствора и  среды. В сильнокислых растворах возможна кислотная ошибка стеклянного электрода, вызываемая участием анионов кислоты в равновесиях на границе стекла с раствором.
среды. В сильнокислых растворах возможна кислотная ошибка стеклянного электрода, вызываемая участием анионов кислоты в равновесиях на границе стекла с раствором.
Достоинства: потенциал стеклянного электрода не искажается в присутствии каких-либо окислительно-восстановительных систем, в растворах солей тяжелых и благородных металлов, органических веществ. Его можно применять в окрашенных и мутных растворах, в средах, не обладающих буферной емкостью, вблизи точки нейтрализации. Стеклянные микроэлектроды позволяют определять  в небольших объемах жидкости и очень удобны для измерения
в небольших объемах жидкости и очень удобны для измерения  в биологических объектах.
в биологических объектах.
Современная теория стеклянного электрода исходит из представления, что потенциал стеклянного электрода возникает в результате ионообменных свойств стекла. Ионы щелочных металлов (катионы натрия или калия), находящихся в стекле обмениваются с находящимися в растворе ионами водорода. Этот обмен идет до установления равновесия:
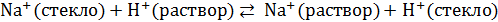 .
.
Равновесие устанавливается на обеих сторонах стеклянной мембраны, и в нем участвуют сравнительно небольшие по толщине поверхностные слои стекла.
Цель работы – определение  серии растворов с помощью хингидронного и стеклянного индикаторных электродов.
серии растворов с помощью хингидронного и стеклянного индикаторных электродов.
Экспериментальная часть
Составляют цепь, состоящую из двух полуэлементов, соединенных электролитическим ключом (рис. 4.1). Один полуэлемент представляет собой стаканчик с исследуемым раствором (2), в который опущен платиновый электрод (1) и добавлен порошок хингидрона. Второй полуэлемент – хлоридсеребряный электрод сравнения (3), опущенный в стаканчик с насыщенным хлоридом калия (4). Стаканчики соединяют электролитическим ключом (5), предварительно заполненным насыщенным раствором хлорида калия. ЭДС цепи 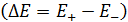 измеряют с помощью высокоомного вольтметра (6). Затем с учетом знака и величины потенциала хлоридсеребряного электрода определяют потенциал хингидронного электрода. Проводят измерения ЭДС и расчет потенциалов для всех исследованных растворов.
измеряют с помощью высокоомного вольтметра (6). Затем с учетом знака и величины потенциала хлоридсеребряного электрода определяют потенциал хингидронного электрода. Проводят измерения ЭДС и расчет потенциалов для всех исследованных растворов.
Электрохимическая схема:
 .
.
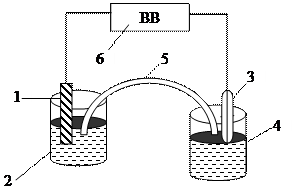 |
Рис. 4.1. Схема измерения ЭДС электрохимического элемента
1 − платиновый электрод; 2 − исследуемый раствор; 3 − хлоридсеребряный электрод сравнения; 4 − насыщенный раствор хлорида калия; 5 − электролитический ключ, заполненный насыщенным раствором 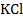 ; 6 − высокоомный вольтметр.
; 6 − высокоомный вольтметр.
Измеряют  всех исследуемых растворов с помощью стеклянного электрода. При смене растворов необходимо обратить внимание на тщательное прополаскивание стеклянного электрода. Измерения проводят не менее 3 раз.
всех исследуемых растворов с помощью стеклянного электрода. При смене растворов необходимо обратить внимание на тщательное прополаскивание стеклянного электрода. Измерения проводят не менее 3 раз.