Построить график зависимости 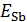 от
от  (рис. 4.3), измеренного стеклянным электродом. В соответствии с разделом 1 «Определение параметров по функциональной зависимости»найти коэффициенты линейного уравнения регрессии и получить эмпирическую зависимость потенциала сурьмянооксидного электрода от
(рис. 4.3), измеренного стеклянным электродом. В соответствии с разделом 1 «Определение параметров по функциональной зависимости»найти коэффициенты линейного уравнения регрессии и получить эмпирическую зависимость потенциала сурьмянооксидного электрода от  .
.
Рис. 4.3. Зависимость потенциала
сурьмянооксидного индикаторного электрода от 
Отчет включает в себя следующие разделы: теоретическая часть, цель работы, схема установки, результаты измерений, расчет потенциала, результаты статистической обработки, график зависимости потенциала хингидронного электрода от  , выводы.
, выводы.
Лабораторная работа 12. Определение размера иона
Под размером ионов 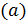 подразумевается «эффективный диаметр» ионов, т. е. такое среднее расстояние, на которое каждый ион может приблизиться к данному иону. «Эффективный диаметр» ионов, вероятно, включает в себя также толщину оболочки, образованную вокруг иона из молекул растворителя.
подразумевается «эффективный диаметр» ионов, т. е. такое среднее расстояние, на которое каждый ион может приблизиться к данному иону. «Эффективный диаметр» ионов, вероятно, включает в себя также толщину оболочки, образованную вокруг иона из молекул растворителя.
Согласно теории Дебая-Гюккеля (II приближение) коэффициент активности ионов i -го сорта в растворе сильных электролитов выражается уравнением (4.5)
 , (4.5)
, (4.5)
где  – средний ионный коэффициент активности в шкале мольных долей,
– средний ионный коэффициент активности в шкале мольных долей,
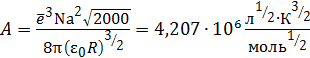 ; (4.16)
; (4.16)
 – величина, обратная радиусу ионной атмосферы, м-1;
– величина, обратная радиусу ионной атмосферы, м-1;
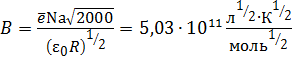 ; (4.17)
; (4.17)
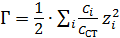 – ионная сила раствора;
– ионная сила раствора;
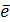 – заряд электрона, 1,602×10-19 Кл;
– заряд электрона, 1,602×10-19 Кл;
 – число Авогадро, 6,022×1023 моль-1;
– число Авогадро, 6,022×1023 моль-1;
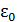 – универсальная электрическая постоянная, 8,85×10-12 Ф/м;
– универсальная электрическая постоянная, 8,85×10-12 Ф/м;
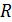 – универсальная газовая постоянная, 8,31 Дж/(моль×К);
– универсальная газовая постоянная, 8,31 Дж/(моль×К);
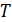 – температура, К;
– температура, К;
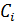 – концентрация иона i -ого сорта;
– концентрация иона i -ого сорта;
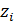 – заряд ионов;
– заряд ионов;
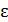 – относительная диэлектрическая проницаемость раствора.
– относительная диэлектрическая проницаемость раствора.
Из уравнения (4.5) следует, что если известна величина коэффициента активности, то можно рассчитать значение эффективного диаметра 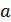 .
.
В свою очередь величину коэффициента активности можно рассчитать, если известен равновесный потенциал при определенной концентрации потенциалопределяющих ионов.
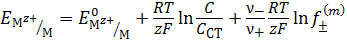 . (4.18)
. (4.18)
Для водных растворов электролитов вплоть до концентрации 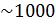 моль/м3 = 1 моль/л различием в численных значениях молярной и моляльной концентраций можно пренебречь. Также невелики различия в значениях коэффициентов активностей в различных шкалах.
моль/м3 = 1 моль/л различием в численных значениях молярной и моляльной концентраций можно пренебречь. Также невелики различия в значениях коэффициентов активностей в различных шкалах.
Цель работы – оценить размер иона и установить зависимость этой величины от концентрации раствора.
Экспериментальная часть
Для определения эффективного размера иона необходимо измерить равновесный потенциал электрода. Вычислить натуральный логарифм коэффициента активности катиона и, воспользовавшись соотношением (4.5), рассчитать величину 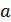 .
.
В качестве объекта исследования берут электрод первого рода: 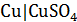 ,
, 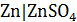 и др. Из исходного раствора с концентрацией ионов металла 0,5 моль/л путем разбавления готовят 5-6 растворов заданной концентрации.
и др. Из исходного раствора с концентрацией ионов металла 0,5 моль/л путем разбавления готовят 5-6 растворов заданной концентрации.
Собирают электрохимическую цепь, состоящую из исследуемого электрода и хлоридсеребряного электрода сравнения:
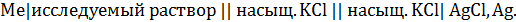
Измеряют ЭДС цепи с помощью высокоомного вольтметра (рис. 4.4). Измерения проводят во всех растворах, начиная с самого разбавленного. Проводят две серии замеров в исследуемых растворах. После первой серии измерений следует сменить электролитический ключ и промыть исследуемый электрод.
Из измеренной ЭДС 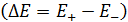 с учетом величины и знака потенциала хлоридсеребряного электрода определяют потенциал исследуемого электрода.
с учетом величины и знака потенциала хлоридсеребряного электрода определяют потенциал исследуемого электрода.
С точностью до градуса записывают температуру, при которой выполнялись опыты.
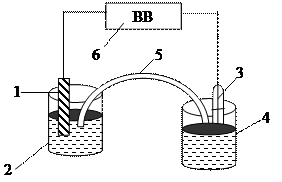 |
Рис. 4.4. Схема измерения ЭДС электрохимического элемента
1 − металлический электрод (медь или цинк); 2 − исследуемый раствор;
3 − хлоридсеребряный электрод сравнения; 4 − насыщенный раствор хлорида калия;
5 − электролитический ключ, заполненный насыщенным раствором 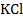 ;
;
6 − высокоомный вольтметр.