НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
АЛКЕНЫ
Алкены – это непредельные углеводороды, молекула которых содержит одну двойную связь. Поскольку первым представителем гомологического ряда алкенов является этилен СН2=СН2, эти вещества называют также углеводородами ряда этилена (этиленовыми углеводородами).
Молекулы алкенов содержат на два атома водорода меньше, чем молекулы алканов с тем же числом атомов углерода. Общая формула алкенов – CnH2n.
Физические свойства алкенов и алканов схожи. Первые три представителя гомологического ряда этиленовых углеводородов при обычных условиях газообразны. Алкены с числом атомов углерода от 5 до 18 жидкости, начиная с углеводорода С19Н38 – твердые вещества. В воде алкены практически не растворяются.
СТРОЕНИЕ МОЛЕКУЛ АЛКЕНОВ
Установлено, что в молекуле этилена ядра всех атомов лежат в одной плоскости, а валентные углы равны 120◦. Такое строение молекулы может быть объяснено на основе представлений о гибридизации орбиталей.
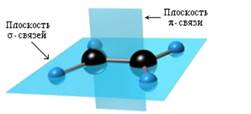
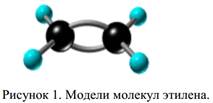
Электронные орбитали атомов углерода, связанных двойной связью, находятся в состоянии sp2-гибридизации. Каждый из этих атомов образует три σ-связи, лежащие в одной плоскости под углами, близкими к 120◦. Не участвующие в гибридизации орбитали p-электронов расположены перпендикулярно плоскости σ-связей и путем бокового перекрывания образуют π-связь. Таким образом, двойная связь представляет собой сочетание одной σ- и одной π-связи (рис. 1).
Двойная связь короче, чем простая: длина связи С=С составляет 0,134 нм, в то время как длина связи С-С равна 0,154 нм.
Электроны π-связи располагаются выше и ниже плоскости σ-связей и создают область повышенной электронной плотности. Таким образом, именно двойная связь становится реакционным центром молекулы алкена.
|
|
НОМЕНКЛАТУРА АЛКЕНОВ
В соответствии с рекомендациями ИЮПАК при построении названий алкенов соблюдают следующие правила.
1. Основную углеродную цепь выбирают таким образом, чтобы она
обязательно включала двойную связь и имела при этом наибольшую длину. На принадлежность углеводорода к классу алкенов указывает суффикс -ен.
2. Атомы углерода в основной цепи нумеруют с того конца, к
которому ближе расположена двойная связь.
3. Перечисляют заместители в алфавитном порядке, указывая перед
каждым заместителем номер атома углерода основной цепи, к
которому он прикреплен, и добавляют название основной цепи.
4. Чтобы обозначить положение двойной связи, в конце названия
цифрой указывают номер атома углерода, от которого она начинается.
Пример. Назовем алкен, структурная формула которого
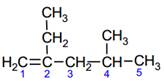
В качестве основной выбираем цепь, содержащую двойную связь и включающую пять атомов углерода. (Отметим, что самая длинная цепь в молекуле состоит из 6 атомов углерода, но, поскольку она не включает двойную связь, выбирать ее в качестве основной нельзя). Атомы углерода основной цепи нумеруем с того конца, к которому ближе располагается двойная связь. Названием основной цепи будет пентен-1.
В молекуле два заместителя – радикалы СН3- и СН3-СН2-. Перечисляем названия заместителей по алфавиту, указывая перед каждым из них цифрой номер атома углерода основной цепи, к которому он прикреплен, и добавляем название основной цепи. Итак, название алкена 4-метил-2 этилпентен-1.
|
|
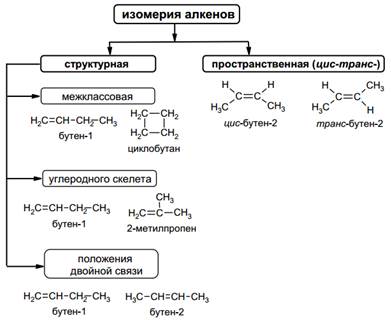
ВИДЫИЗОМЕРИИ
Для алкенов характерна как структурная, так и геометрическая (цис-транс -) изомерия. Структурная изомерия алкенов обусловливается различным строением углеродного скелета молекулы (изомерия углеродного скелета) и различным положением двойной связи в углеродной цепи (изомерия положения двойной связи).
ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ
Благодаря присутствию двойной связи алкены гораздо более химически активны, чем алканы. Именно двойная связь является реакционным центром их молекул. Для алкенов наиболее характерны реакции присоединения, окисления и полимеризации.
Реакции присоединения
· Гидрирование
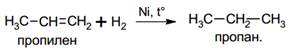
· Галогенирование
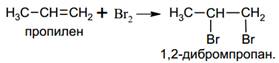
Эта реакция является качественной на непредельные углеводороды, в том числе на алкены.
· Гидрогалогенирование
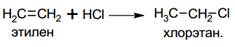
При присоединении галогеноводородов к несимметричным алкенам выполняется правило Марковникова: атом водорода преимущественно присоединяется к более гидрированному атому углерода при двойной связи.
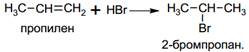
· Гидратация
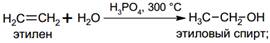
СПОСОБЫПОЛУЧЕНИЯ
· Промышленные способы
Дегидрирование алканов. В качестве катализаторов этого процесса используют металлы платиновой группы (Pt, Pd, Ni) или Cr2O3, нанесенный на пористый инертный носитель. Температура варьируется от 300 до 600оС:
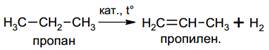
· Лабораторные способы
1. Дегалогенирование
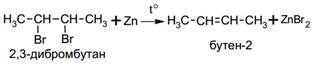
2. Дегидратация спиртов

АЛКИНЫ
Алкинами называются ненасыщенные углеводороды, имеющие в своем строении тройную углерод-углеродную связь. Общая формула алкинов СnН2n-2 (-ин).
Углерод, участвующий в образовании тройной связи, имеет следующее электронное строение:
|
|
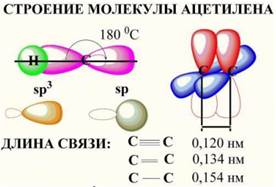
Кроме sp3- (тетраэдрической) и sp2- (тригональной) гибридизации, имеется ещё: комбинация одной 2s-орбитали и одной 2р-орбитали. Образуются две эквивалентные гибридные sр-орбитали которые расположены на одной прямой. Угол между sр-орбиталями 180°. При образовании тройной связи гибридные орбитали атомов углерода участвуют в построении σ-связи. Две другие р-орбитали, расположенные под прямым углом друг к другу не участвуют в этой гибридизации и образуют между собой две π-связи, во взаимно перпендикулярных плоскостях. Молекула ацетилена линейная (плоская) невозможна (невозможна) цис -, транс -.
Для алкинов характерны реакции присоединения, идущие в две ступени. Степень ненасыщенности в алкинах выше, чем в алкенах, и можно было бы
ожидать, что тройная связь должна быть более реакционноспособной, чем двойная. Однако в большинстве случаев по активности в этих реакциях алкины не превосходят алкены и даже уступают им. Электронная плотность тройной связи расположена более компактно, чем в алкенах, и электроны π-связей удерживаются ядрами более прочно. Особенностью алкинов является наличие у некоторых из них так называемого ацетиленового атома Н. Алкины с концевой тройной связью проявляют слабые СН-кислотные свойства и способны отщеплять протон. Этим они отличаются от алканов и алкенов. Заметные СН-кислотные свойства алкинов обусловлены большей
электороотрицательностью атома С в sр-гибридизованном состоянии:
sр3 (2.5) < sр2 (2.8) <sp (3.1) (э.о.)
Физические свойства
Как и у алканов низшие члены гомологического ряда алкенов и алкинов (С2-С4) - газы, далее (С5- С17(16)) жидкости, высшие (С18(17)) гомологи - твёрдые вещества. Алкены и алкины, подобно алканам, нерастворимы в воде, но хорошо растворимы в малополярных органических растворителях - бензоле, эфире, тетрахлорметане.
СПОСОБЫПОЛУЧЕНИЯ
· Промышленные
Пиролиз углеводородов.
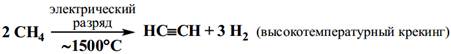
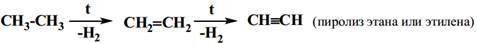
· Препаративные (лабораторные)
1. Дегидрогалогенирование из геминальных дигалогеналкилов.
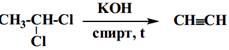
2. Гидролиз карбида кальция
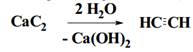
ХИМИЧЕСКИЕ СВОЙСТВА
· Присоединение водорода.
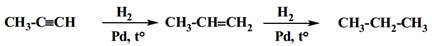
· Присоединение галогенов
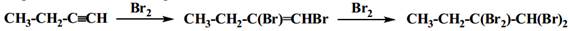
Обобщение изученного материала
Домашнее задание
Напишите структурные формулы веществ, названия которых:а) пентан, б)2-метилпентан, в)пентен-1, г)пентин-1, д)пентанол-1.