По принципу соответственных состояний термодинамические свойства веществ (в том числе и коэффициенты сжимаемости различных газов), имеющих равные

Рис. 2.10. Коэффициенты сверхсжимаемости углеводородных газов,
в зависимости от приведённых параметров
приведенные температуры и давления, приблизительно одинаковы, так как при этом различные газы находятся как бы в одинаковом относительном приближении к жидкому состоянию. Поэтому графики коэффициента сверхсжимаемости z, в приведенных координатах для углеводородов одного гомологического ряда совпадают с точностью, достаточной для практики. На этом основании график (рис. 2.10) может быть использован для вычисления удельного объема и других параметров любого газа (в том числе и газовых смесей), если известны его критические параметры (табл.2.4).
Графики (рис. 2.10) действительны для газа, не содержащего значительных количеств неуглеводородных компонентов. Большую часть неуглеводородных компонентов обычно составляет азот. Поэтому коэффициент сверхсжимаемости газа можно рассчитать по правилу аддитивности из формулы
 , (2.32)
, (2.32)
где  – мольная доля азота;
– мольная доля азота;  — коэффициент сверхсжимаемости азота (рис. 2.11);
— коэффициент сверхсжимаемости азота (рис. 2.11); 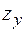 — коэффициент сжимаемости углеводородной части газа.
— коэффициент сжимаемости углеводородной части газа.

Рис. 2.11. Зависимости коэффициентов сверхсжимаемости азота от давления и температуры
С помощью коэффициента сверхсжимаемости z легко определить объемы газа V в различных условиях. В соответствии с уравнением (2.30) объем газа в любых условиях (температура Т и давление р) будет равен
 . (2.33)
. (2.33)
Объёмный коэффициент газа используется при пересчете объема, занимаемого газом при нормальных условиях на пластовые условия, и наоборот, например, при подсчёте запасов.
Плотность газов
За относительную плотность газа принимается число, показывающее, во сколько раз масса данного газа, заключенная в определенном объеме при данном давлении и температуре, больше или меньше массы сухого воздуха, заключенного в том же объеме при нормальных условиях:
 , (2.34)
, (2.34)
где ρr и ρв — плотности газа и воздуха в кг/м3. Чем жирнее газ, т. е. чем больше он содержит тяжелых компонентов, тем больше его плотность.
Плотность газа может быть также найдена по его относительной молекулярной массе. Для смеси газов их средняя (кажущаяся) молекулярная масса рассчитывается по известному Мольному компонентному составу газа по формуле
 , (2.35)
, (2.35)
где М — средняя относительная молекулярная масса газа; M1, М2,..., Мп — относительные молекулярные массы соответствующих компонентов; y1, y2,..., уп — мольные доли компонентов. Один киломоль (кмолъ) любого газа при нормальных условиях занимает объем, равный 22,4 м3. Следовательно, относительная плотность газов (по воздуху) может быть определена по их средним молекулярным массам из соотношения
 , (2.36)
, (2.36)
Кроме того, по известной плотности газа при нормальных условиях средняя молекулярная масса газа может быть найдена по формуле
М = 22,4ρ0. (2.37)
В табл. 2.5 приведены величины относительной плотности (относительно воздуха) некоторых газов.
Таблица 2.5. Относительная плотность некоторых газов (относительно воздуха)
| Газ | Относительная плотность |
| Воздух | |
| Гелий | 0,138 |
| Азот | 0,97 |
| Углекислый газ | 0,518 |
| Сероводород | 1,191 |
| Метан | 0,55 |
| Этан | 1,038 |
| Пропан | 1,52 |
| Бутан | 2,0065 |
Плотности многих углеводородных газов и сероводорода больше плотности воздуха (табл. 2.5). Поэтому они могут накапливаться в помещениях насосных, в колодцах и т. д., где возможны пропуски газа в арматуре оборудования. Это необходимо учитывать при проектировании промыслового хозяйства, при проведении работ на промысле и принимать меры к устранению вредного влияния газов на здоровье персонала.
Вязкость газов
Вязкость — одно из свойств газов, определяющих закономерности движения их в газоносных пластах. Вязкость газа в зависимости от изменения параметров, характеризующих его состояние, изменяется сложным образом. При низких давлениях и температурах свойства реальных газов приближаются к идеальным. Закономерности изменения вязкости газов при различных давлениях и температурах можно объяснить, исходя из некоторых положений кинетической теории газов. Динамическая вязкость газа связана с его плотностью рг, средней длиной свободного пути λ, и средней скоростью молекул ν соотношением
 . (2.38)
. (2.38)
Формула (2.38) определяет зависимость динамической вязкости газа от давления и температуры. При повышении давления плотность газа возрастает, но при этом уменьшается средняя длина свободного пробега молекул, а скорость их не изменяется. Поэтому с увеличением давления динамическая вязкость газа вначале практически остается постоянной. Из формулы (2. 38) также следует, что с увеличением температуры вязкость газа должна возрастать, так как скорость молекул ν увеличивается, если даже ρ и λ остаются постоянными. Отмеченный характер изменения вязкости газов объясняется проявлением внутреннего трения. Количество движения из слоя в слой передается вследствие перелета молекул газа в движущиеся друг относительно друга слои. При этом возникают силы, тормозящие движение одного слоя и увеличивающие скорость движения другого. С повышением температуры увеличиваются скорость и количество движения, передаваемое в единицу времени, и, следовательно, больше будет вязкость. Поэтому вязкость газов почти не зависит от давлений, если они близки к атмосферному, и увеличивается с ростом температуры. В пределах одного гомологического ряда вязкость газов уменьшается с возрастанием молекулярной массы. Однако при повышении давления эти закономерности нарушаются — с увеличением температуры понижается вязкость газа, т. е. при высоких давлениях вязкость газов изменяется с повышением температуры аналогично изменению вязкости жидкости. Газы с более высокой молекулярной массой, как правило, имеют и большую вязкость. В сжатом газе перелет молекул в движущиеся друг относительно друга слои затруднен и передача количества движения из слоя в слой происходит в основном, как у жидкостей, за счет временного объединения молекул на границе слоев.
При содержании в углеводородном газе более 5 % азота следует учитывать его влияние на вязкость газа и оценивать средневзвешенную вязкость смеси по правилу аддитивности
 , (2.39)
, (2.39)
где μ — динамическая вязкость смесей углеводородных газов и азота; μа и μу — динамические вязкости азота и углеводородной части смеси газов; уа — мольная доля азота в составе газа.