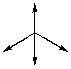
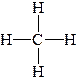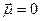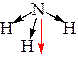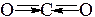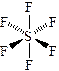| Пример 1. Рассмотрим молекулу метана (CH4): Атом углерода в возбужденном состоянии имеет конфигурацию 2s12p3 и образует 4 σ-связи – по одной с каждым атомом водорода. Следовательно, на валентном уровне атома углерода оказывается 4 связывающих пары, а неподеленные пары отсутствуют. В гибридизации принимают участие все орбитали, на которых есть хотя бы один электрон. В данном случае гибридизации подвергаются 1 (одна) s -орбиталь и 3 (три) p ‑орбитали. Такой тип гибридизации получил название sp3 -гибридизация. При этом получились 4 (четыре) sp3 -гибридных орбитали (вспомните про пример кофе с молоком). Аналогичный результат можно получить на основании теории отталкивания электронных пар. При образовании четырех σ‑связей на валентном уровне атома углерода формируются четыре связывающих пары, а неподеленные пары отсутствуют. Общее количество электронных пар (стерическое число) равно 4. Стерическое число 4 соответствует sp3 -гибридизации. Далее задача становится сугубо геометрической: как в пространстве разместить 4-х драчунов на максимальном удалении друг от друга? Отталкивающиеся друг от друга орбитали в пространстве принимают направление к вершинам правильного тетраэдра. Поскольку все орбитали заняты связывающими парами электронами связей C-H, следовательно, геометрия молекулы метана представляет собой правильный тетраэдр, валентный угол составляет 109°28` (это значение необходимо запомнить – это величина угла между связями C-H (угол H-C-H), которое следует из соображений геометрии. Очевидно, что атом углерода попадает в центр сферы описанной, вокруг тетраэдра CH4). Валентный угол – угол между химическими связями. Обозначим направления дипольных моментов связей. Сложение векторов дипольных моментов связей равно диплоьному моменту молекулы (в данном случае – ноль), следовательно, молекула неполярна. |
2p3
2s1
4 σ-связи sp3-гибридизация Направление – к вершинам правильного тетраэдра Геометрия – правильный тетраэдр В. угол = 109°
Молекула неполярна |
Как Вы видите, понятие гибридизации позволило нам определить геометрию молекулы, в том числе, валентные углы. Затем, зная геометрию молекулы, мы с легкостью смогли предсказать полярность молекулы.
| Пример 2. Рассмотрим молекулу воды (H2O): Электронная конфигурация валентного уровня атома кислорода 8O … 2s22p4. Атом кислорода благодаря двум неспаренным электронам образует 2 σ-связи (2 связывающие пары) с атомами водорода (структурная формула), кроме того на валентном уровне находятся 2 неподеленные пары. В гибридизацию вступают все орбитали валентного уровня (на всех есть электроны), следовательно, гибридизация sp3. Иначе: 2 связывающие и 2 неподеленные пары – всего 4, следовательно, стерическое число равно 4, что соответствует sp3 ‑гибридизации. Отталкивающиеся друг от друга орбитали в пространстве принимают направление к вершинам правильного тетраэдра. В этот раз орбитали неодинаковые: две заняты неподеленными парами, а две – связывающими. Электронные пары невидимы, поэтому в пространстве можно различить только три небольших шарика, соответствующих ядрам атомов. Такая геометрия молекулы угловая. Валентный угол близок к 109o (такой угол задает гибридизация sp3), однако объем неподелённой пары больше, чем связывающей, поэтому валентный угол < HOH меньше 109°, приблизительно 104-105°. Обозначим направления дипольных моментов связей. Сложение векторов по правилу треугольника или по правилу параллелограмма дает новый ненулевой вектор (обозначен красным цветом), следовательно, молекула полярна. |
2p4
2s2
2 σ-связи СП = 2, НП = 2, ст.ч. = 2 + 2 = 4. sp3-гибридизация Направление – к вершинам правильного тетраэдра Геометрия – угловая В. угол ~ 109°, В. угол < 109°
Молекула полярна | ||||||
| Пример 3. Рассмотрим молекулу аммиака (NH3): Атом азота имеет электронную конфигурацию валентного уровня 7N … 2s22p3 и, благодаря трём неспаренным электронам, образует 3 σ-связи (структурная формула, 3 связывающие пары), кроме того, на валентном уровне находится 1 неподеленная пара. В гибридизации участвуют все четыре орбитали, гибридизация sp3. Иначе: Три связывающих пары и одна неподеленная пара соответствуют стерическому числу 4, т.е. гибридизации sp3 Отталкивающиеся друг от друга орбитали в пространстве принимают направление к вершинам правильного тетраэдра. Орбитали неодинаковые: одна занята неподеленной парой, а три – связывающими парами. Такая геометрия молекулы – треугольная пирамида. Валентный угол < HNH меньше 109°, приблизительно 107-108°. Обозначим направления дипольных моментов связей. Сложение векторов по правилу треугольника или по правилу параллелограмма дает новый ненулевой вектор (обозначен красным цветом), следовательно, молекула полярна. |
2p3
2s2
3 σ-связи sp3-гибридизация Направление – к вершинам правильного тетраэдра Геометрия – треугольная пирамида В. угол ~ 109°, В. угол < 109°
Молекула полярна | ||||||
| Пример 4. Рассмотрим молекулу углекислого газа (CO2): Атом углерода в возбуждённом состоянии имеет электронную конфигурацию 6C … 2s12p3 и образует 2σ-связи и 2π-связи, (структурная формула) неподеленных пар у атома углерода нет. Внимание: π-связи образуются негибридизованными p‑ орбиталями, т.е. p -орбитали, израсходованные на образование таких связей (в данном случае две) в гибридизации не участвуют. Иначе. Поскольку π-связи «привязаны» к σ-связям, при расчете стерического числа их не учитывают, стерическое число равно 2. Отталкивающиеся друг от друга орбитали в пространстве принимают направление в противоположные стороны. Обе орбитали заняты связывающими парами, геометрия молекулы – линейная. Валентный угол < OCO = 180°. Обозначим направления дипольных моментов связей. Сложение векторов даёт 0, молекула неполярна. |
2p3
2s1
2 σ-связи sp-гибридизация Направление – «в разные стороны» Геометрия – линейная В. угол = 180°
Молекула неполярна | ||||||
| Пример 5. Рассмотрим молекулу фторида бора (BF3): Атом бора в возбуждённом состоянии имеет электронную конфигурацию 5B … 2s12p2 и образует 3σ-связи (структурная формула) с атомами фтора. Неподеленные пары на валентном уровне атома бора отсутствуют. Вакантная орбиталь, так как не занята электронами, в гибридизации не учитывается. Следовательно, гибридизация sp2. Иначе: Вакантная орбиталь при подсчете стерического числа не учитывается, общее число электронных пар на валентном уровне равно трем, т.е. стерическое число 3, гибридизация sp2. Отталкивающиеся друг от друга орбитали в пространстве принимают направление к вершинам правильного треугольника. Все орбитали заняты связывающими парами, геометрия молекулы – правильный треугольник. Валентный угол < FBF = 120°. Обозначим направления дипольных моментов связей. Сложение векторов даёт 0, молекула неполярна. |
2p2
2s1
3 σ-связи sp2-гибридизация Направление – к вершинам правильного треугольника Геометрия – правильный треугольник В. угол = 120°
Молекула неполярна | ||||||
| Пример 6. Рассмотрим молекулу хлорида фосфора(V) (PCl5): Атом фосфора в возбуждённом состоянии имеет электронную конфигурацию 15P … 3s13p33d1 и образует 5 σ-связей – по одной с каждым атомом хлора (структурная формула), неподеленных пар нет. В гибридизации участвуют все занятые орбитали валентного уровня, т.е. гибридизация sp3d. Иначе: стерическое число равно 5, гибридизация sp3d. Отталкивающиеся друг от друга орбитали в пространстве принимают направление к вершинам треугольной бипирамиды. Все орбитали заняты связывающими парами, геометрия молекулы – треугольная бипирамида. Валентные углы: < Cla P Cle = 90°, < Cle P Cle = 120°, < Cla P Cla = 180°. Обозначим направления дипольных моментов связей. Сложение векторов даёт 0 как в плоскости xy треугольника, так и по оси z. Молекула неполярна. | P* … 3s1 3p3 3d1
5 σ-связей sp3d-гибридизация Направление – к вершинам треугольной бипирамиды. Геометрия – треугольная бипирамида < Cla P Cle = 90°, < Cle P Cle = 120°, < Cla P Cla = 180°.
Молекула неполярна | ||||||
| Пример 7. Рассмотрим молекулу фторида серы (VI): Атом серы во втором возбуждённом состоянии имеет электронную конфигурацию 16S … 3s13p33d2, образует 6 σ‑связей с атомами фтора (структурная формула), неподеленные пары отсутствуют. В гибридизации участвуют все занятые орбитали валентного уровня, т.е. гибридизация sp3d2. Иначе: стерическое число равно 6, гибридизация sp3d2. Отталкивающиеся друг от друга орбитали в пространстве принимают направление к вершинам октаэдра. Все орбитали заняты связывающими парами, геометрия молекулы – октаэдр. Октаэдр представляет собой две правильных пирамиды, в основании которых лежит квадрат, склеенные по основанию. При этом боковые ребра пирамид равны ребрам основания (сторонам квадрата). Валентные углы: < Fa S Fa = 180°, < Fa S Fe = 90°, < Fe S Fe = 90°. Обозначим направления дипольных моментов связей. Сложение векторов даёт 0 как в плоскости xy, так и по оси z. Молекула неполярна. | S** … 3s1 3p3 3d2
6 σ-связей sp3d2-гибридизация Направление – к вершинам октаэдра. Геометрия – октаэдр < Fa S Fe = 90°, < Fe S Fe = 90°, < Fa S Fa = 180°
Молекула неполярна | ||||||
Вывод. Образование ковалентных связей и общих электронных пар вследствие межэлектронного отталкивания приводит к такому свойству ковалентной связи, как направленность, которая определяет геометрию (пространственное строение) молекулы.