Необходимо изучить материал и выполнить задания.
1. Прочитать материал по теме
2. Написать практическую работу в тетрадь.
3. Выполнить практическое задание Опыт №1, Опыт №2.
Практическая работа № 21: Водородное топливо и водородные топливные элементы.
Цель: представить водород как альтернативный вид топлива, как топливо будущего.
Задачи:
1. Проанализировать основные характеристики водорода, обладающего уникальными свойствами.
2. Подтвердить гипотезу о водороде как альтернативный вид топлива, как топливо будущего.
3. Провести лабораторный эксперимент по получению водорода в лаборатории.
Ход работы
1. Физические свойства водорода
2. Что такое водородная технология?
3. Моторные характеристики. Преимущества водородных двигателей внутреннего сжигания.
4. Сколько получают водорода и для каких целей?
5.Практическая работа по получению водорода в лабораторных условиях.
6. Заключение
7. Выводы
Существует несколько способов получения водорода в лабораторных условиях.
Получение водорода действием разбавленных кислот на металлы. Металлы, расположенные в электрохимическом ряду напряжений выше водорода, реагируют с разбавленной серной или соляной кислотой, образуя соль и водород. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту:

Получение водорода с помощью электролиза. При электролизе разбавленных водных растворов щелочей или кислот на катоде происходит выделение водорода, например

Получение водорода действием щелочей на цинк или алюминий. Цинк и алюминий реагируют с водными растворами гидроксида натрия или гидроксида калия, образуя водород:

Получение водорода гидролизом ионных гидридов. Ионные гидриды, как, например, гидрид кальция, реагируют с холодной водой, образуя водород:
 [1]
[1]
(Приложение № 2)
3.2.Выполнение практической работы по получению водорода в лабораторных условиях.
В ходе проведения работы был проведен химический эксперимент по способам получения водорода.
Опыт №1.
Для проведения химической реакции использовали цинк и разбавленную соляную кислоту:
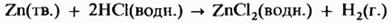
В ходе опыта нужно было подтвердить гипотезу о силе водорода как источнике энергии. Газоотводную трубку от прибора для получения газов направили в пустую консервную банку с закрытым бумажной полоской отверстием и подождали в течение часа. Подожгли лучинку и поднесли к отверстию консервной банки и результат опыта подтвердился – раздался хлопок и банка подпрыгнула с песочной основы на 5см. Такой опыт можно назвать «летающая банка», если собрать больше водорода в металлической банке. В смеси водорода с кислородом при комнатной температуре реакция не протекает. Однако при поджигании смеси происходит реакция со взрывом. Если объемы водорода и кислорода находятся в соотношении 2:1, то происходит сильный взрыв. Такую смесь называют гремучим газом.
Чистый водород в пробирке сгорает с тихим звуком. Если же водород смешан с воздухом, то он взрывается с лающим звуком, такая смесь опасна. При поджигании водорода пробирку держат вверх дном, так как водород легче воздуха. В результате реакции горения водорода образуется вода: 2H2 + O2 = 2H2O.
Опыт № 2. Водород из алюминия и щелочи.
Используемый раствор щелочи – гидроксид натрия. Насыпаем в колбу небольшое количество гидроксида натрия и заливаем 50 -100 мл воды, перемешиваем раствор до полного растворения кристаллов. Далее добавляем несколько кусочков алюминия. Сразу же начнется реакция с выделением водорода и тепла, сначала слабая, но постоянно усиливающаяся. Дождавшись пока реакция будет происходить более активно, аккуратно добавим еще 10г щелочи и несколько кусочком алюминия. Закупориваем колбу, пробиркой с трубкой, ведущей сосуд для сбора газа. Ждем примерно 3 -5 мин., пока водород вытеснит воздух из сосуда. Алюминий является активным металлом, то он начинает реагировать с водой, растворяясь в ней, при этом выделяется водород.
2Al + 2NaOH + 6H 2O → 2Na [Al(OH) 4] + 3H 2↑
Сколько получают водорода и для каких целей?
Водород получают в газообразном виде и, если для использования необходим жидкий водород, его подвергают глубокому охлаждению и ожижению.
Производство молекулярного водорода в 1985 году достигло примерно 57 млн. тонн (без СССР), а в 1990 году уже 95. Если вспомнить, что водород — это газ, который в 14,5 раза легче воздуха, то станет ясно, какой это громадный объем.
Вывод.
В результате работы узнали о таком важном, незаменимом, и интереснейшем веществе на нашей планете, как водород. И если есть возможность предотвратить попадание этих опаснейших веществ в атмосферу, то почему мы этого до сих пор не сделали, почему это не сделали не мы, а те, кто этим должен заниматься?
В ходе работы я узнала, что у нашего мира ещё есть возможность хоть как-то наладить экологическую обстановку. В ходе работы видим из всех доказательств, приведённых в работе, что водород – это не просто элемент, водород – это чудо, и сейчас его не без оснований называют чудесным топливом будущего. Выделение энергии в ядерных реакциях в миллионы раз превышает энеровыделение при обычном горении. Ввиду быстрого истощения ресурсов естественных источников энергии на Земле (нефть, газ, уголь) актуальной является проблема овладения ядерной и водородной энергией.