Все существующие у бактерий механизмы, позволяющие им выживать в присутствии токсичных концентраций ТМ в среде, можно отнести к нескольким основным типам. Это активное выведение (выброс) металла из клетки, ограничение поступления металла за счет изменения клеточной проницаемости, внутриклеточное связывание металла и его детоксикация, внеклеточное связывание, энзиматиче-ская детоксикация металла в менее токсичную форму и снижение металл-чувствительности клеточных компонентов (Gadd, 1990; Wang, 1997; Bruins, 2000).
Активный транспорт металлов из микробных клеток. Микроорганизмы используют механизмы активного транспорта для выведения токсичных металлов из цитоплазмы. Металлы, не имеющие физиологического значения, обычно входят в клетку через транспортные каналы, предназначенные для необходимых катионов, но затем быстро выводятся из клетки (Sar, 1998; Hao,1999). Обнаружено, что системы активного выброса ионов могут быть как АТФ-независимыми, так и использующими энергию АТФ. Все они являются высокоспецифичными для катионов или анионов, которые экспортируются из клетки (Nies,1995). Описано достаточно большое количество разновидностей этого механизма металл-резкстентности у бактерий. Например, известно о существовании двух типов систем активного выведения ионов Cd2+ из бактериальной клетки. Ионы Cd2+ поступают в клетку через транспортную систему для катионов магния и/или марганца (Hao,1999). У грам-положительных бактерий система cad активного выведения Cd2+ из клетки использует протеины, относящиеся к Р-типу АТФ-аз, т. е. является зависимой от использования энергии АТФ. Впервые эта система была описана для Staphylococcus aureus. Позднее были найдены белки, относящиеся к Р-типу АТФ-аз и способные к активному транспорту из бактериальных клеток ионов Cu2+, Pb2+, Zn2+ (Rosen, 1996; Nies,1999). У грам-отрицательных бактерий существует другая транспортная система czc (кадмий/цинк/кобальт),которая регулируется градиентом концентрации протонов Н+ через внутреннюю мембрану и является АТФ-независимой. Функционирование czc системы впервые подробно было изучено на примере бактериального штамма Alcaligenes eutrophus CH34 (Collard, 1994; Diels, 1995). С помощью этой системы темы выброса из бактериальных клеток- могут удаляться катионы Cd2+, Zn2+ Co2+ (Rosen, 1996; Bruins, 2000; Nies, 2000). Ионы Ni2+ экспортируются с помощью гомологичной nсr (никель/кобальт) системы, способной удалять из клетки также ионы Со2+ (Nies,1999).
Ограничение поступления металлов за счет изменения проницаемости клеток. В условиях повышенных концентраций ТМ в среде у микроорганизмов могут происходить структурные изменения в клеточной стенке, оболочке, цитоплазматической мембране. Эти процессы не всегда являются результатом токсического действия металлов. Они могут быть проявлением индуцируемых защитных механизмов, обеспечивающих ограничение поступления токсичных ионов в цитоплазму клетки и воздействия на жизненно важные клеточные компоненты (Алексеева, 1991).
Пример такого защитного механизма подробно описан для бактерий Escherichia coli. Снижение поступления избыточных концентраций Си (II) в клетку происходит за счет индуцированного нарушения синтеза белка порина, участвующего в формировании мембранных транспортных каналов (Rouch, 1995).
Известно существование явления аккумулирования Сu (II) в периплазматическом пространстве и в наружной клеточной мембране у бактерий Pseudomonas syringae за счет связывания со специфическими протеинами. Их синтез регулируется сор -опероном, являющимся Сu-индуцируемым (Coocsey,1994).
Некоторые штаммы Staphylococcus aureus характеризуются конформационными изменениями в клеточной мембране, обусловленными экспрессией плазмидных генов. В результате ограничивается поступление в клетку ионов Cd2+ и других токсичных металлов. Этот механизм проявляется при концентрации Cd (II) от 0,01 до 0,1 nМ. Сходный механизм устойчивости к Со2+ выявлен у Со-резистентного штамма Pseudomonas putida (Иванов, Гаврюшкин, 1999).
Значительное преимущество для выживания в средах, содержащих металлы, получают бактериальные штаммы, характеризующиеся наличием полисахаридной капсулы (Иванова, Горшкова, 1994; Иванова, 2001; Gadd, 1990). Многие бактерии продуцируют большое количество внеклеточных полисахаридов, которые обладают анионными свойствами и, таким образом, действуют как биосорбенты для катионов металлов. Установлено, что внеклеточный матрикс является эффективным внешним барьером и предотвращает или существенно ограничивает поступление ионов металлов в клетку (Gadd, 1990). При сравнении степени Cd и Сu устойчивости капсулированных и некапсулированных штаммов Klebsiella aerogenes обнаружено, что выживаемость капсулированных форм бактерий в присутствии металлов была на несколько порядков выше по сравнению с выживаемостью некапсулированных форм (Bitton, Freihofer, 1978), цит. по (Trevors, 1986). Предположительно, высокая устойчивость к Cd у бактериальных штаммов, выделенных из дальневосточных морей, обусловлена наличием среди них большого числа капсулированных форм (Иванова, Горшкова, 1994; Иванова, 2001).
Катионы поливалентных токсичных металлов могут связываться также липополисахаридами, входящими в состав наружной клеточной мембраны грам-отрицательных бактерий, что способствует иммобилизации металлов и предупреждает их проникновение в клетку (Ford,1992).
Внутриклеточное связывание токсичных металлов и их детоксикация. Аккумулирование металла в цитоплазме и его детоксикация может происходить за счет связывания токсичных ионов со специфическими протеинами, синтезируемыми клеткой. Этот процесс предотвращает воздействие тяжелых металлов на структурные и функциональные компоненты клетки. С помощью такого механизма могут быть детоксифицированы катионы Cd2+, Cu2 + и Zn2+. Связывающей способностью по отношению к ионам Т М обладают специфические внутриклеточные белки - металлотионеины (Bruins, 2000). Извсех прокариотов способность к их синтезу ютильио изучена и описана только для некоторых видов цианобактерий Synechococcus sp. (Silver et. al., 1989), цит. по (Bruins, 2000). Было установлено, что бактерии Pseudomonas putida, изолированные из сточных вод, могли синтезировать три низкомолекулярных белка, богатых цистеином, возможно родственные металлотиокеинам (Trevors, 1986). Однако дальнейших экспериментальных подтверждений этот факт не получил (Bruins, 2000).
Ионы металлов, поступившие в цитоплазму бактериальной клетки, могут быть связаны неорганическими анионами. Это также ведет к детоксикации металла, поскольку образовавшиеся соединения являются малорастворимыми. У бактерий рода Citrobacter Макаски с соавт. показали внутриклеточное аккумулирование Cd в форме фосфата (Macaskie et. al., 1987), цит. по (Ford,1992). Айкин с соавт. выявили у представителей этого же рода бактерий механизм внутриклеточного накопления РЬ в форме гидрофосфата - PbHPO4 (Aickin et. al., 1979), цит. по (Ford,1992). Способность к внутриклеточному накоплению фосфата РЬ(П) в виде гранул проявлял штамм Pseudomonas aeruginosa CHL-004, выделенный из почвы, загрязненной свинцом (Davis-Hoover, 1998).
Для Mycobacterium scrofulaceum обнаружена способность к внутриклеточной аккумуляции Сu (II) в форме сульфида (Mergeay, 1991) цит. по (Bruins, 2000).
Внеклеточная изоляция металлов. Микроорганизмы обеспечивают внеклеточную изоляцию токсичных металлов за счет связывания их в малорастворимые соединения с продуктами метаболизма, поступившими во внешнюю среду (Ehrlich,1997).
Многие органические метаболиты бактерий играют важную роль в обеспечении детоксикации ТМ, за счет способности связывать ионы металлов в прочные комплексы (Ford,1992). Экспериментально установлено, что морские цианобактерии Synechococcus sp. могут влиять на химические формы содержания Сu в морской воде. При токсичных концентрациях свободных ионов Сu2+ в среде цианобактерии продуцируют внеклеточные хелатирующие лиганды, которые соединяются в прочные комплексы с ионами Сu2+, снижая их биодоступность. Константа нестойкости этих соединений сопоставима со значениями констант нестойкости комплексных соединений Сu (II) в морской воде. Бактериальный синтез хелатирующих лигандов регулируется концентрацией свободных ионов Сu2+в среде по принципу обратной связи (Moffet, 1996).
Микроорганизмы способны выделять в среду в качестве продуктов метаболизма неорганические анионы (сульфид-, карбонат- или фосфат- ионы), которые связывают катионы ТМ в малорастворимые соединения (Gadd, 1990; Ford,1992). Например, результаты электронно-микроскопического исследования показывают, что металл-резистентные штаммы Klebsiella aerogenes способны осаждать Pb, Hg, или Cd в форме сульфидных гранул на внешней поверхности клеток (Gadd, 1990).
В одних случаях, образование анионов, осаждающих металлы, может быть результатом нормального клеточного метаболизма, как образование сульфидов в анаэробных условиях сульфат-восстанавливающими бактериями рода Desulphovibrio. В других случаях, процесс является индуцируемым при определенных условиях среды. Например, образование сульфидов бактериями рода Clostridia, как проявление механизма металл-резистентности (Chapelle, 1993).
Процесс осаждения металлов, как механизм металл-резистентности, является эффективным только в том случае, когда результирующая концентрация растворенного металла в среде становится ниже минимального ингибирующего уровня для бактерий (Ehrlich,1997).
Энзиматическая детоксикация металлов в менее токсичную форму. Наиболее изученным примером проявления механизма металл-резистентности у бактерий, связанного с процессом внутриклеточной энзиматической детоксика-ции металла, является система устойчивости к Hg (II) (Gadd, 1990; Nies,1999). Она обусловлена функционированием теr оперона и выявлена как у грам-положительных (Staphylococcus aureus, Bacillus sp.) так и у грам-отрицательных бактерий (Escherichia coli, Pseudomonas aeruginosa, Serratia marcescens, Thiobacillus ferrooxidans} (Gadd, 1990); (Misra, 1992) цит. no (Bruins, 2000). В результате экспрессии генов, составляющих тег оперон, Hg(II) в две стадии восстанавливается до металлической Hg(0), которая затем диффундирует через клеточную мембрану и выделяется в окружающую среду. Металлическая ртуть обладает летучестью, поэтому содержание ее в среде может быстро сокращаться (Silver, 1996).
Изучены и описаны механизмы энзиматического окисления бактериальными клетками Alcaligenes faecalis соединений As(III), присутствующего в форме AsO2- , до соединений As(V) в форме AsO43-, являющихся менее токсичными (Anderson, 1992).
Обнаружено, что бактерии Pseudomonas fluorescens LB300 и Enterobacter cloaсае способны восстанавливать соединения О (VI) до менее токсичных соединений Сг (III) (Cervantes, 1992; Ehrlich,1997).
Снижение металл-чувствительности клеточных компонентов.
Некоторые микроорганизмы адаптируются к присутствию токсичных металлов за счет изменения чувствительности клеточных компонентов, что обеспечивает определенную степень их естественной защиты (Rouch, 1995). Защита достигается или за счет мутаций, которые снижают металл-чувствительность клеточных компонентов, не изменяют выполняемых ими основных функций, или за счет увеличения синтеза специфических компонентов клетки, являющихся необходимыми для инакти-кации металлов (Rouch, 1995). Включение механизмов репарации обеспечивает частичную защиту плазмидной и хромосомной ДНК (Bruins, 2000; Ford, 2000). На примере штаммов Escherichia coli было показано, что в присутствии Cd (II) в среде неадаптированные бактерии характеризуются высокой частотой повреждений ДНК. которая снижается у адаптированных штаммов, предварительно культивируемых в среде, содержащей Cd (II). В процессе адаптации происходит удлинение лаг-фазы роста бактерий, когда индуцируются механизмы репарации ДНК. Чем дольше культивируют бактерии в Cd-содержащей среде, тем короче становится продолжительность лаг-фазы роста (Мегgeay, 1991) цит. по (Bruins, 2000).
Получение металл-резистентных штаммов Pseudomonas putida 448, Pseudomonas fluorescens 331 и Klebsiella pneumoniae 332 в модельном эксперименте
В качестве модельных объектов исследования были использованы штаммы грамотрицательных бактерий: Pseudomonas putida 448,. Штаммы были выделены из воды бухты Золотой Рог, относились к доминирующим таксономическим группам и специально не адаптировались к высоким концентрациям тяжелых металлов. Культуры штаммов хранились в полужидкой питательной среде YK с морской водой (Youchimizu, Kimura, 1976) под минеральным маслом при температуре +4 ºС.
Были проанализированы спектр и уровни металлоустойчивости штаммов. Минимальные ингибирующие концентрации определялись путем посева штаммов в пробирки с жидкой средой YK с добавлением возрастающих концентраций хлоридов Cd, Cu, Co, Ni, Zn и нитрата Pb. Концентрации безводных солей металлов в среде изменялись в следующих диапазонах: CdCl2 (10–200 мг/л), ZnCl2 (100 – 500мг/л), NiCl(100 – 1500 мг/л), CuCl2 (100–500 мг/л), CoCl2 (100–400 мг/л), PbNO3 (80 – 1800). Для анализа ультраструктурных изменений в клетках бактерий были подобраны такие концентрации солей металлов в среде, которые не вызывают видимых изменений в интенсивности роста и максимально близки к минимальным ингибирующим концентрациям Cu (300 мг/л), Со (200 мг/л), Ni (500 мг/л), Cd (60 мг/л), Zn (200 мг/л), Pb (1000 мг/л).
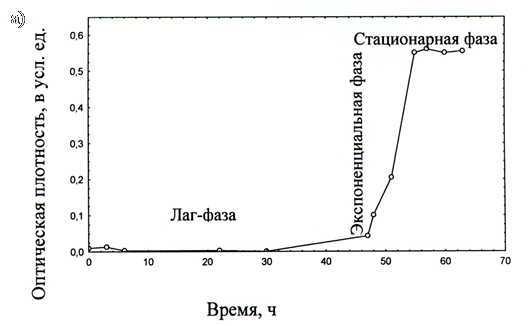
Кинетику роста штаммов оценивали в присутствии тяжелых металлов на основе определения оптической плотности культур через определенные промежутки времени при длине волны 600 нм. Измерения проводили с использованием КФК-3-01 фотометра. На основе полученных данных строили графики кривых роста культур.
Способность резистентных штаммов к аккумулированию металлов оценивали по понижению концентрации металла в среде на различных стадиях роста культуры в течение 48 часов. Для этого проводили анализ 5 мл порции инокулята в начале лаг-фазы, конце экспоненциальной фазы роста культуры и при длительном культивировании (3 месяца).. Для осаждения биомассы проводили центрифугирование в режиме 5000 об/мин в течение 20 мин.
Концентрацию металла определяли атомно-абсорбционным методом с использованием спектрофотометра (модель АА-6601 F, пламенный вариант). Для минерализации образцов использовали концентрированную HNO3. Концентрацию металла в сырой биомассе бактерий определяли тем же методом.
Отбор образцов биомассы штаммов для электронной микроскопии проводился в лаг-фазе (по прошествии 1 ч.) для бактерий Pseudomonas putida 448 и Klebsiella pneumoniae 332, выращенных на средах с Cd2+ и Cu2+; в конце логарифмической фазы кривой роста (через 42 ч после начала культивирования) для всех штаммов бактерий.
Бактериальные суспензии фиксировали по Ито в течение 1 часа, постфиксацию проводили в 1% растворе ОsO4, дегидратировали в этаноле возрастающей концентрации и заливали в смолы SPURR – embedding (SIGMA). Срезы получали на ультрамикротоме «УЛЬТРАКАТ Е» и помещали на медные сетки.
Ультратонкие срезы на сетках контрастировали в 1% спиртовом растворе уранилацетата и цитратом свинца. Готовые препараты были просмотрены в трансмиссионный микроскоп JEM-100B.
Электронно-микроскопическое исследование показало резкое изменение ультраструктуры бактериальных клеток штаммов Pseudomonas putida 448, Pseudomonas fluorescens 331 и Klebsiella pneumoniae 332, выращенных на средах, содержащих металлы, по сравнению с клетками культур, выращенных на питательных средах, не содержащих металлы и адаптированных для культивирования морских бактерий. При этом разные металлы не всегда вызывали одинаковые ультраструктурные изменения у одного и того же штамма, что может свидетельствовать о различных механизмах резистентности микроорганизма к воздействию тяжелых металлов.
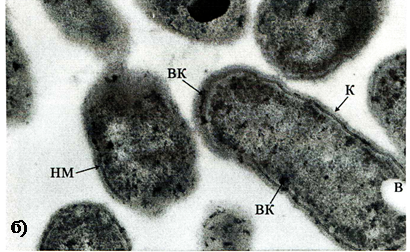
Кинетика роста культуры и морфология бактериальных клеток металл-резистентного штамма Pseudomonas putida 448. Изучение ультратонких срезов штамма P. рutida 448, культивируемого на селективной среде с Cu2+, в сравнении с клетками, выращенными на среде, не содержащей соли меди (рис. 15), позволило выявить изменения в строении клеток уже на ранних этапах роста культуры – в лаг-фазе (1ч после начала культивирования) (рис. 16). В цитоплазме клеток наблюдались немногочисленные осмиофильные округлые включения, количество которых значительно увеличилось в клетках бактерий через 42 ч после начала культивирования (к концу экспоненциальной - начало стационарной фазы роста культуры). У клеток, находящихся в начале стационарной фазы, наблюдалось большое количество вакуолеподобных структур – электронно-прозрачных зон округлой формы, что не отмечалось в клетках, находящихся в лаг-фазе.
Вакуолеподобные структуры были обнаружены в клетках культур этого же штамма, культивируемых на Cd-содержащей среде, в начале стационарной фазы роста, (рис. 17). Здесь обнаружено также утолщение ригидного слоя клеточной стенки. Известно, что у P. putida конформационные изменения в клеточной стенке обусловлены экспрессией плазмидных генов, отвечающих за резистентность к Cd (Иванов, Гаврюшкин, 1999).
Образование немногочисленных электронно-прозрачных зон и небольшое утолщение регидного слоя в клетках, выращенных в присутствии кадмия, наблюдалось уже на ранних стадиях культивирования – в лаг-фазе (18). В цитоплазме некоторых клеток отмечены одиночные или немногочисленные осмиофильные включения, окруженные электронно-светлыми зонами, или же находящиеся рядом с вакуолеподобными структурами. При длительном культивировании в присутствии кадмия наблюдаются процессы деградации клеточных структур (рис. 19).
При культивировании этого штамма в присутствии Со+, к концу экспоненциальной фазы, на поверхности клеток образуется мощный слой аморфного вещества (рис. 20а,б), который не выявлялся у клеток, культивируемых на среде с Cu2+ и Cd2+.
Колонии P. рutida 448, выращенные на селективной Со-содержащей среде, изменили цвет, приобретя розоватый оттенок, соответствующий цвету некоторых солей кобальта. На ультраструктурном уровне, происходило увеличение контрастности клеток, в результате возможного связывания ионов металла с полифосфатами или с другими органическими соединениями. В клеточной стенке было хорошо выражено периплазматическое пространство, и также наблюдались более контрастные участки в наружной мембране. Контрастность, в данном случае, можно объяснить связыванием металла фосфатными или карбоксильными группами мембраны. Подобный механизм резистентности известен для многих бактерий, в том числе и для P. syringae (Gadd, 1990).
В клетках, культивируемых на среде с Со+, появлялись вакуолеподобные структуры, но в меньших количествах по сравнению с клетками, культивируемыми на среде с медью.
При культивировании P. putida 448 на селективной Pb-содержащей среде не было отмечено каких-либо, приведенных выше, видимых изменений в ультраструктуре клеток (рис. 21). При этом четко выявлялся нуклеоид с тонкими нитями ДНК и в поле зрения микроскопа отмечено большое количество сильно удлиненных клеток. Наблюдаемое изменение морфологии может быть связано с преимущественным подавлением клеточного деления, что также, как известно из литературных данных, наблюдается при действии большинства ТМ и на другие виды бактерий (Perguson et al., 1979 – цит по: Сенцова, Максимов, 1985).
Сравнительный анализ ультраструктуры клеток Pseudomonas fluorescens 331, и Pseudomonas putida 448, выращенных на средах с тяжелыми металлами. Сравнительный анализ электронографий выявил различную реакцию у представителей одного рода Pseudomonas на присутствие в среде одних и тех же металлов.
Так, изучение ультратонких срезов клеток штаммов P. fluorescens 331, культивируемых на среде, содержащей Cu2+ в сравнении с контролем (рис. 22), уже на начальных стадиях роста (рис. 23), показало наличие у них хорошо развитого слоя аморфного вещества на поверхности клеток (рис.24), отсутствующего у P. рutida 448, культивированных на среде с Cu2+, но имеющегося у клеток, подвергшихся воздействию Co+ (рис. 25). Также как и у P. рutida 448, культивируемой на Co-содержащей среде, клетки P. fluorescens 331, подвергшихся действию Cu2+, отличались большой контрастностью и хорошо выраженным периплазматическим пространством. У некоторых клеток имелись электронно-светлые участки, по-видимому, места локализации запасных веществ, разрушившихся в результате обработки материала. В клетках также наблюдали большое количество гранул и электронно-плотных включений игольчатой структуры в цитоплазме. В некоторых случаях они пронизывали клеточную стенку. Здесь также возможно нахождение металлов в составе полифосфатных или сульфидных гранул, или же за счет связывания катионов со специфическими внутриклеточными белками-металлотианинами (Baxter, Jensen, 1980 – цит. по Сенцова, Максимов, 1985; Bruins, Kapil, 2000).
Cd2+ оказывал на P. fluorescens 331 такое же воздействие, как на P. putida 448 (рис. 24). В частности, вызывая увеличение ригидного слоя клеточной стенки. Известно, что у псевдомонад действие ионов кадмия вызывает изменение состава белков внешней мембраны и периплазматического пространства, оболочки бактериальной клетки, и не затрагивает цитоплазму (Алексеев и др., 1991).
Присутствие большого количества вакуолеподобных структур было характерно для клеток с мощным аморфным слоем на поверхности P. рutida 448, выращенных на среде с Сu2+ и Cd2+, и P. Fluorescens 331, культивируемых на среде с Cd2+. В этом случае наблюдалось больше гранул ПФ, чем в клетках, не имеющих аморфного вещества.
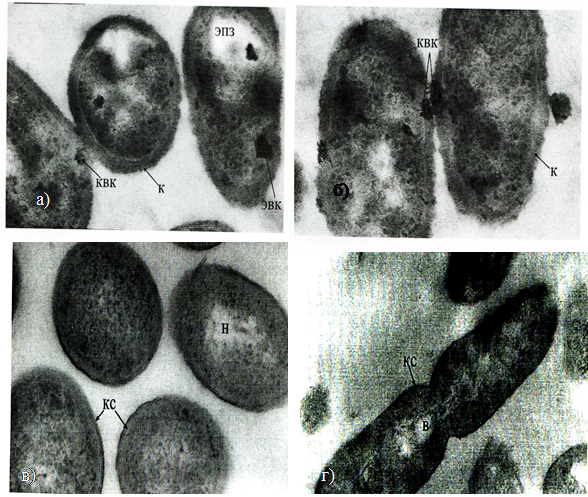
Ультраструктура клеток Klebsiella pneumoniae 332, выращенных на средах с тяжелыми металлами. Электронно-микроскопический анализ показал, что на поверхности большинства клеток Klebsiella pneumoniae 332, по сравнению с контролем (рис.26), культивируемых на Cu-содержащей среде в начале стационарной фазы (рис.27, 28), имеются округлые, по-видимому, полифосфатные или сульфидные гранулы. Способность осаждать Pb2+, Hg+ или Cd2+ в форме сульфидных гранул на поверхности клеток была описана Gadd G.M.(1990) для металл-резистентных штаммов K. aerogenes. Выявленные крупные неоформленные конгломераты могут образовываться за счет связывания с неорганическими анионами (Bruins, Kapil, 2000; Ford, 1992).
У большинства клеток в эксперименте обнаружены электронно-прозрачные зоны, не имеющие резких границ. Ультратонкое строение этих же бактерий в лаг-фазе кардинально не отличалось от строения клеток контрольной культуры, лишь у немногих клеток в цитоплазме обнаруживали очень мелкие одиночные электронно-плотные вкрапления.
Электронно-прозрачные зоны также наблюдали у этого штамма при культивировании на селективных средах, содержащих Ni+ и Pb2+ (рис. 29, 30, 31).
В клетках, выращенных на среде с Ni+, была более выражена капсула и отмечено небольшое количество электронно-плотных агрегатов.
У бактерий, культивируемых в присутствии Pb2+, наблюдались крупные электроннопрозрачные зоны в центре клетки, в результате чего, происходило смещение цитоплазмы к клеточной стенке. Обнаруживаемые электронно-плотные конгломераты были немногочисленны и имели меньшие размеры, в сравнении с клетками культуры, выращенной на Cu-содержащей среде.
Следует отметить, что у клеток Klebsiella, выращенных на средах с Pb2+, Ni+, Cu2+, цитоплазма отличалась высокой электронной плотностью и вакуолизированностью. Подобный эффект был описан при действии Ni+ на морскую бактерию Arthrobacter marinus (Cobet et al., 1970 – цит. по: Сенцова, Максимов, 1985). В ее клетках образовались огромные вакуоли, и протоплазма отходила к стенкам. Авторы предположили, что внутриклеточное пространство заполняют некие высокомолекулярные соединения.
При действии на культуру K. рneumoniae 332 Cu2+, Ni+ и Pb2+ реализуются одни и те же механизмы резистентности, заключающиеся в связывании ТМ внутри клетки, образовании капсулы и появлении электронно-прозрачных зон, в которых, вероятно, содержатся высокомолекулярные соединения. Причем электронно-плотных конгломератов отмечалось меньше в тех клетках, где размеры и количество этих зон больше. При действии на клетки K. рneumoniae 332 ионов Cd не выявлялось каких-либо резких изменений в цитоплазме, приведенных выше, но наблюдалось расширение ригидного слоя клеточной стенки, которая приобретала неровную поверхность.
Результаты электронно-микроскопического исследования свидетельствуют об изменениях ультраструктур бактерий, подвергшихся влиянию тяжелых металлов. Действие высоких концентраций тяжелых металлов выражается в изменении толщины и структуры клеточной стенки, появлении аморфного вещества на поверхности клеток, формирования вакуолеподобных структур и включений различной формы и размеров в зависимости от штамма и металла.
Можно предположить, что при воздействии Со+, Cd2+ и Cu2+, наблюдаемые электронно-прозрачные зоны, являются местом, где запасается поли-β-оксимасленая кислота (ПОМК), которая, как известно, присутствует у всех представителей рода Pseudomonas и окружена однослойной белковой мембраной (Шлегель, 1987). Считается, что ПОМК служит регулятором окислительно-восстановительных процессов в клетках и может выполнять функцию электронного стока, то есть избыток восстановителей может быть накоплен в осмотически и химически нейтральном соединении (Кулаев 1996).
Другим запасным веществом, способным связывать ТМ, могут быть полифосфаты (ПФ) и сульфиды (Pramod et al., 2000). Показано, что ПФ могут принимать участие в поддержании тонкой структурной организации клеточной стенки и мембраны, а также в транспорте ионов металлов в клетку. В связи с тем, что ПФ присутствуют в клетках в виде солей тех или иных ионов металлов, их можно рассматривать как резервы этих ионов, регулирующих уровень тех или иных катионов в клетке (Кулаев, 1996).
Следует отметить, что осмиофильные включения в клетках, выращенных на Cd-содержащей среде, наблюдались лишь в лаг-фазе (в начале стационарной – они отсутствуют), подобные включения встречаются и в клетках лаг-фазы, выращенных на Cu-содержащей среде. Это может свидетельствовать о включении общих механизмов резистентности для этих металлов на ранних стадиях культивирования – на стадии адаптации к среде. В экспоненциальной фазе наблюдали различия в ультраструктуре клеток, что говорит об активации разных механизмов адаптации.
Высокая аккумулирующая способность штамма P. рutida 448 по отношению к Cu2+ и Cd2+, подтвержденная методом атомно-абсорбционного анализа, по-видимому обусловлена связыванием тяжелых металлов с ПФ, сульфидами и ПОМК.
В зависимости от того, какой металл превалирует в среде, включаются разные механизмы резистентности. Так, наибольшая аккумулирующая способность клеток K. рneumoniae 332, проявляется по отношению к ионам Cu, чем к ионам Cd. На ультратонких срезах клеток, культивированных на Cu-содержащей среде, хорошо выявляются электронно-плотные конгломераты – места вероятной аккумуляции ионов металла, отсутствующие в клетках, выращенных в присутствии Cd2+.
Возможны одинаковые механизмы утилизации одного и того же металла у бактерий разных родов. Так р. Pseudomonas и р. Klebsiella обнаруживают одинаковые ультраструктурные изменения при действии ионов кадмия, что свидетельствует о включении общих механизмов адаптации по отношению к кадмию у микроорганизмов.
Таким образом, при культивировании штаммов трех видов граммотрицательных бактерий: Pseudomonas putida 448, Pseudomonas fluorescens 331 и Klebsiella pneumoniae 332, устойчивых к высоким концентрациям тяжелых металлов, происходит реализация различных механизмов резистентности в зависимости от вида бактерии, природы металла и его концентрации, что отражается в изменении ультраструктурной организации клетки.
ЗАКЛЮЧЕНИЕ
Изучение механизмов утилизации тяжелых металлов, как основных загрязнителей морской среды, микроорганизмами позволяет получить представление как о процессах адаптации микробных клеток к действию поллютантов, так и о процессах самовосстановления среды.
Представленные в атласе фотографии позволяют увидеть ультраструктурные изменения бактериальных клеток под действием тяжелых металлов на различных стадиях роста культуры морских микроорганизмов: на стадии адаптации к факторам среды, на стадии интенсивного роста и при длительном культивировании. На примере бактерий рода Pseudomonas проведен сравнительный анализ ультраструктурных изменений, происходящих в клетках различных штаммов, относящихся к одной таксономической группе. Дана сравнительная оценка ультраструктурных изменений микробных клеток под действием тяжелых металлов, происходящих у представителей разных родов, на примере бактерий родов Pseudomonas и Klebsiella.
Так, действие высоких концентраций тяжелых металлов на металлоустойчивые штаммы бактерий p. Pseudomonas и р. Klebsiella вызывает видимые изменения ультраструктуры клеток, проявляющейся в изменении толщины и структуры клеточной стенки, появлении хорошо развитой капсулы, формировании вакуолеподобных структур, образовании электронно-плотных конгломератов на поверхности и внутри клеток.
Ультраструктурные изменения под действием ионов меди и кадмия отмечаются уже в лаг-фазе роста бактериальных культур и проявляются в появлении мелких осмиофильных гранул внутри клеток, что характерно для всех исследованных штаммов. Индивидуальность реакции штаммов на уровне ультраструктур по отношению к тяжелым металлам выявляется на стадии интенсивного роста культур (экспоненциальная фаза роста культуры). Показано, что бактерии p. Pseudomonas и p. Klebsiella обнаруживают одинаковые ультраструктурные изменения при действии ионов кадмия.
Одними из возможных механизмов аккумуляции тяжелых металлов в клетках P. putida 448, P. fluorescens 331 и К pneumoniae могут являться накопление их в форме сульфидов и связывание с запасающими веществами (полифосфатами, поли-β-оксимасляной кислотой).
Изучение механизмов адаптации позволяет оценить потенциальную возможность и направленность процессов самовосстановления среды. Важное практическое применение могут найти штаммы – ремедианты.
| |||||||||
 | |||||||||
 | |||||||||
 | |||||||||
 |  | ||||||||
|
 | |||||||
| |||||||
 |  |
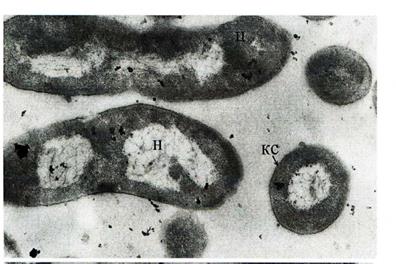
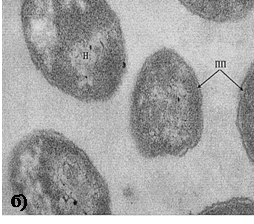
Рис. 19. Тонкое строение клеток Pseudomonas putida 448, после культивирования на Cd-содержащей среде в течение 3 месяцев,
а) клетки с деструктивными изменениями. Увел. 25000;
б) морфологически целые клетки. Увел. 30000.
кс - клеточная стенка, н - нуклеоид.
 | |||||||||
 | |||||||||
| |||||||||
 | |||||||||
 | |||||||||
 |
 | |||||
| |||||
 |
Рис. 23. Изменение концентрации ионов Cu2+ в среде ( ) в ходе культивирования штамма Pseudomonas fluorescens 331 (
) в ходе культивирования штамма Pseudomonas fluorescens 331 ( ).
).
 | |||||||||||||
| |||||||||||||
 |  | ||||||||||||
 | |||||||||||||
|
 | |||||||
| |||||||
 | |||||||
|
 |  | |||||
