Получение сульфаниламидов
К настоящему времени синтезировано большое число сульфаниламидов пролонгированного действия с самыми различными радикалами в молекуле.
Поскольку в основе всех сульфаниламидов лежит одна и та же структура — сульфаниламидный остаток
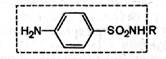
схема синтеза их примерно одинакова.
1. Получение хлорангидрида сульфаниловой кислоты.
2. Получение соответствующего аминопроизвод-ного.
3. Конденсация хлорангидрида сульфаниловой кислоты с аминопроизводным.
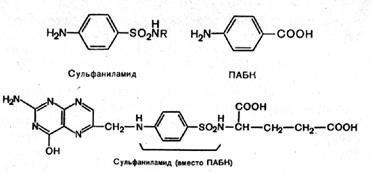
1-я стадия для всех сульфаниламидов общая. Ввиду того что сульфаниловая кислота не может быть непосредственно превращена в хлорангидрид, ее предварительно ацетилируют уксусным ангидридом и затем уже получают хлорангидрид действием пентахлорида фосфора. Для ацетилирования берут натриевую соль сульфаниловой кислоты.

2-я стадия синтеза индивидуальна для каждого препарата и зависит от характера R.
На 3-й стадии полученный ранее хлорангидрид ацилсульфаниловой кислоты конденсируют с соответствующим амином.
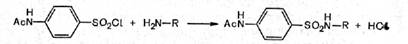
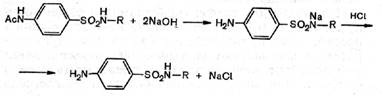
Реакцию следует проводить в слабощелочной среде, чтобы нейтрализовать выделяющуюся хлороводородную кислоту, которая может вступить в реакцию с амином, образуя гидрохлориды, и тогда реакция конденсации амина с хлорангидридом ацилсульфаниловой кислоты не пойдет.
Далее ацильную группу омыляют, так как ацилиро-ванные соединения не обладают терапевтическим эффектом. Поскольку омыление ацильной группы ведется раствором гидроксида натрия, продукт омыления получается в виде растворимой натриевой соли. Ее обрабатывают кислотой и затем подвергают очистке, в результате образуется соответствующий сульфаниламид.
Физические свойства
Одновременно с синтезом сульфаниламидных препаратов проводилась работа по установлению связи между химическим строением сульфаниламидов и их физиологическим действием.
Основные закономерности этой связи сводятся к следующему.
1. Физиологическая активность сульфаниламидов обусловлена наличием сульфанильного радикала в молекуле.
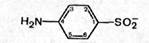
2. Перемещение аминогруппы из положения 4 в другие положения ароматического ряда приводит к полной потере физиологической активности.
3. Любое производное сульфаниламида с замещенной аминогруппой в положении 4 может быть физиологически активным лишь в том случае, если в организме может снова образоваться свободная аминогруппа.
4. Введение в ароматическое ядро дополнительных заместителей либо снимает, либо уменьшает физиологическую активность.
5. При введении различных радикалов в сульфамидную группу молекулы физиологическая активность может меняться в зависимости от характера радикала либо в сторону увеличения, либо уменьшения.
6. Для обеспечения длительного действия существенное значение имеет наличие в молекуле метоксильных групп (почти все препараты длительного действия в отличие от препаратов непродолжительного действия имеют метоксильные группы ОСНз в гетероциклическом ядре —R).
Предполагают, что метоксигруппа определяет более высокий процент связывания сульфаниламида с белками плазмы, что и обусловливает длительность действия препарата.
Механизм антимикробного действия сульфаниламидов связан с их конкурентным антагонизмом 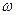 -аминобензойной кислотой (ПАБК).
-аминобензойной кислотой (ПАБК).
Для нормальной жизнедеятельности и роста многих микроорганизмов необходима фолиевая кислота, которая синтезируется в микробной клетке из ПАБК, глутаминовой кислоты и птерина.

Так как сульфаниламиды имеют близкое химическое структурное сходство с ПАБК, они захватываются микробной клеткой вместо n-аминобензойной кислоты, нарушая тем самым синтез фолиевой кислоты. Образующееся соединение, лишенное ПАБК, не может быть дальше использовано микробной клеткой в качестве питательного фермента, и рост микроорганизмов приостанавливается.
Таким образом, в отличие от веществ бактерицидных или антисептических, которые убивают микроорганизмы за счет денатурации их белков, сульфаниламиды оказывают бактериостатическое действие, что связано с нарушением биосинтеза фолиевой кислоты — жизненно необходимого ростового компонента для микроорганизмов.
Все сульфаниламидные препараты представляют собой кристаллические порошки белого или слегка желтоватого цвета, без запаха. Кислотные формы их плохо растворимы в воде, но хорошо растворимы в некоторых органических растворителях — этаноле, ацетоне. Каждый препарат обладает характерной температурой плавления. Натриевые соли сульфаниламидов хорошо растворимы в воде и нерастворимы в органических растворителях.
Химические свойства
Имея близкую химическую структуру, сульфаниламидные препараты обладают рядом общих химических свойств, обусловливающих общие реакции их идентификации. В основном эти общие реакции обусловлены наличием трех функциональных групп: ароматических аминогруппы, сульфогруппы и имидной группы.
Некоторые реакции присущи ароматическому ядру.

Большинство сульфаниламидов являются амфотерными веществами — у них выражены и кислотные, и основные свойства. Последние обусловлены наличием аминогруппы в ароматическом ядре. Как основания они могут растворяться в кислотах с образованием солей.
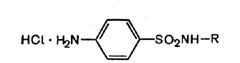
Однако соли их в водных растворах сильно гидролизованы и практически не существуют.
Кислотные свойства сульфаниламидов обусловлены наличием атома водорода имидной группы, который способен замещаться на металлы с образованием солей. Поэтому в большинстве своем сульфаниламидные препараты легко растворяются и в гидроксидах щелочных металлов, и в карбонатах.

Кислотные свойства сульфаниламидов выражены сильнее, чем основные.
1. Реакции, обусловленные ароматической аминогруппой —NH2:
а) реакция диазотирования и азосочетания с фенолами (реакция ГФ) при действии на сульфаниламид нитритом натрия в кислой среде образуется соль диазония, которая при сочетании с фенолом в щелочной среде образует азокраситель.
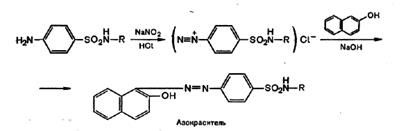
Сульфаниламиды с замещенной аминогруппой, например стрептоцид растворимый, фталазол, фтазин, дают эту реакцию после предварительного гидролиза, который проводят при нагревании с разведенной хлороводородной кислотой;
б) реакция конденсации с альдегидами (образование окрашенных оснований Шиффа); сульфаниламидные препараты, как и другие ароматические амины, со многими альдегидами образуют окрашенные продукты конденсации типа оснований Шиффа, что широко используется в фармацевтическом анализе для целей идентификации ароматических аминов. Реакция протекает в кислой среде.
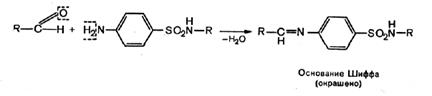
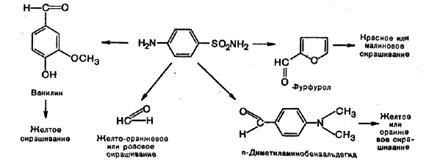
В зависимости от характера альдегида, вступающего во взаимодействие с сульфаниламидом, цвет, получающихся продуктов конденсации различный.
2. Реакции, обусловленные сульфогруппой —SCV. Все сульфаниламидные препараты имеют в своем составе серу сульфамидной группы. Для открытия серы необходимо окислить органическую часть молекулы концентрированной азотной кислотой, при этом сера переходит в сульфатную, которую легко можно обнаружить с раствором хлорида бария.

3. Реакции, обусловленные имидной группой —NH. Атом водорода имидной группы обусловливает возможность взаимодействия сульфаниламидов с солями тяжелых металлов (CuSO4; СоС12 и др.). Получаемые соединения представляют собой окрашенные вещества, растворимые или нерастворимые в воде. При этом цвет осадка или раствора для каждого сульфаниламидного препарата различный, что дает возможность отличать один препарат от другого. Это характеризует данную реакцию как частную, позволяющую определять индивидуальность препарата.
Реакция эта выполняется с натриевыми солями сульфаниламидов. Сульфаниламид сначала нейтрализуют раствором гидроксида натрия, затем добавляют раствор соли тяжелого металла. Следует избегать избытка гидроксида натрия, так как в этом случае может образовываться гидроксид металла, который будет маскировать основную реакцию.
ГФ для нейтрализации имидной группы рекомендует определенное, установленное опытом количество гидроксида натрия, необходимое для образования натриевой соли.
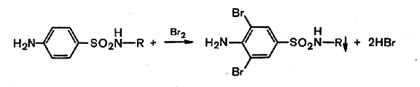
4. Реакции, обусловленные ароматическим ядром. Имея ароматическое ядро, сульфаниламиды могут галоидироваться, нитроваться, сульфироваться.
Методы количественного определения
Методы количественного определениясульфаниламидных препаратов основываются на их химических свойствах и характере функциональных групп. Общим методом количественного определения сульфаниламидных препаратов, рекомендуемым ГФ, является метод нитритометрии.
Данный метод основан на способности сульфаниламидов образовывать диазосоединения. Стандартным раствором служит нитрит натрия. Конец титрования устанавливается либо по внешнему индикатору (йод-крахмальная бумажка), либо по внутреннему (тропеолин-00), либо потенциометрически.
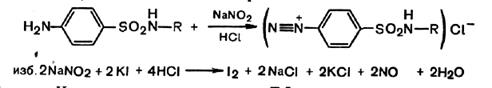
Кроме метода, принятого ГФ, для количественного определения сульфаниламидных препаратов можно использовать и другие методы:
а) метод нейтрализации, основанный на способности сульфаниламидов проявлять кислотные свойства, обусловленные наличием атома водорода имидной группы; кислотные формы сульфаниламидов титруются в спиртовой среде раствором гидроксида натрия или калия с индикатором тимолфталеином.
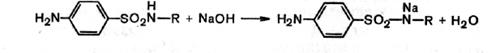
Учитывая слабые кислотные свойства сульфаниламидов, можно применить титрование в неводном растворителе, например диметилформамиде.
Натриевые соли сульфаниламидов, как, например, сульфацил-натрий, титруются кислотой в спиртоацето-новой среде в присутствии метилового оранжевого;

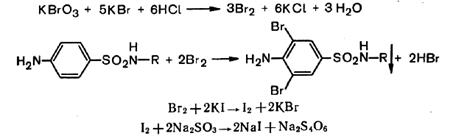
б) броматометрический метод, основанный на способности сульфаниламидов галоидироваться; стандартным раствором служит бромат калия, титрование ведется в кислой среде в присутствии бромида калия. Избыток брома определяется иодометрически;
в) фотоколориметрический метод, основанный на способности сульфаниламидов давать окрашенные продукты реакции с альдегидами, солями тяжелых металлов; для данного метода могут быть использованы и азокрасители. Сравнивая интенсивность окраски исследуемого раствора со стандартным раствором, можно судить о количестве вещества в препарате.
Все сульфаниламидные препараты хранятся по списку Б в хорошо укупоренной таре. Натриевые соли следует хранить в условиях, исключающих действие влаги и света, вследствие возможного гидролиза.
Высшая разовая доза внутрь всех сульфаниламидов короткого действия 2 г, высшая суточная — 7 г.