Задание
1. Конспект по теме «Алкены», любые 5 заданий для самостоятельного выполнения
2. Конспект по теме «Сопряжённые алкадиены», 5 заданий для самостоятельного выполнения
Конспекты и ответы на задания скидывать мне в л/с
Углеводороды
Алкены
Цель: изучить строение, номенклатуру, способы получения, физические и химические свойства, применение алкенов
План лекции
1. Строение алкенов
2. Способы получения
3. Физические свойства
4. Химические свойства
Алкены (непредельные углеводороды, этиленовые углеводороды, олефины) – непредельные алифатические углеводороды, молекулы которых содержат двойную связь. Общая формула ряда алкенов CnH2n.
По систематической номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на – ен: этан (СН3-СН3) – эт ен (СН2=СН2); пропан (СН3-СН2-СН3) - проп ен (СН2=СН-СН3) и т.д. Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь (т.е. она может быть не самой длинной). Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи. Цифра, обозначающая положение двойной связи, ставится обычно после суффикса –ен.
В молекуле алкена ненасыщенные атомы углерода находятся в sp2 -гибридизации, а двойная связь между ними образована s- и p-связью. sp2 -Гибридные орбитали, направлены друг к другу под углом 120°, и одна негибридизованная 2р-орбиталь, расположенную под углом 90° к плоскости гибридных атомных орбиталей.
Пространственное строение этилена:
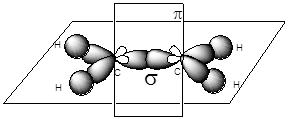
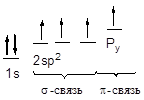
Длина связи С=С 0,134 нм,
энергия связи С=С ЕС=С = 611 кДж/моль, энергия p-связи Еp = 260 кДж/моль.
Виды изомерии: а) изомерия цепи; б) изомерия положения двойной связи
Способы получения
1. CH3-CH3 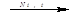 CH2=CH2 + H2 (дегидрирование алканов)
CH2=CH2 + H2 (дегидрирование алканов)
2. C2H5OH 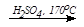 CH2=CH2 + H2O (дегидратация спиртов)
CH2=CH2 + H2O (дегидратация спиртов)
Физические свойства
Низшие члены гомологического ряда алкенов с С2Н4 до С4Н8 – газы, начиная с С5Н10 – жидкости, с С18Н36 – твёрдые вещества. Алкены практически нерастворимы в воде, но хорошо растворяются в органических растворителях.
Химические свойства
Для алкенов характерны, главным образом, реакции присоединения, приводящие к разрыву двойной связи. Большинство реакций протекает при 200С
Качественные реакции: обесцвечивание растворов Br2 и KMnO4 при 200С
1. CH2=CH2 + Br2 ®CH2Br-CH2Br (присоединение галогенов, качественная реакция)
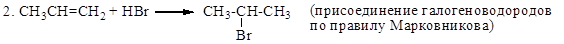
3. CH2=CH2 + H2 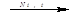 CH3-CH3 (гидрирование)
CH3-CH3 (гидрирование)
4. СH2=CH2 + H2O  CH3СН2OH (гидратация)
CH3СН2OH (гидратация)
5. 3CH2=CH2 + 2KMnO4 + 4H2O ® 3CH2OH-CH2OH + 2MnO2¯ + 2KOH
(мягкое окисление, качественная
реакция)
6. СН2=СН-СН2-СН3 + KMnO4  CO2 + C2H5COOH (жесткое окисление)
CO2 + C2H5COOH (жесткое окисление)
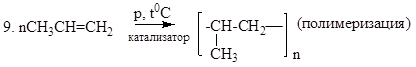
Задания для самостоятельного решения
1. Напишите уравнения реакций взаимодействия пропена со следующими веществами: а) водородом (в присутствии катализаторов), б) бромом, в) бромоводородом, г) серной кислотой.
2. Напишите структурные формулы всех изомерных углеводородов состава С5Н12 и назовите их по систематической номенклатуре.
3. С помощью каких химических реакций можно очистить пропан от примеси пропена?
4. Напишите структурные формулы всех алкенов состава С8Н16, образующихся при каталитическом дегидрировании 2,2,4-триметилпентана, и назовите их по систематической номенклатуре.
5. Напишите структурную формулу алкена состава С6Н12, имеющего один четвертичный атом углерода, и назовите его по систематической номенклатуре.
6. Напишите уравнение реакции дегидратации спирта, приводящей к образованию бутена-1. Укажите условия.
7. Напишите уравнение реакции присоединения хлороводорода к пропилену. По какому правилу протекает это присоединение?
8. Приведите не менее трёх химических реакций, в результате которых может быть получен этилен. Укажите необходимые условия протекания реакций.
9. Какие из перечисленных веществ могут попарно вступать в реакции: пропан, этилен, бром? Напишите уравнения реакций и укажите условия их протекания.
10. Какие спирты можно получить гидратацией пропена; бутена-1; бутена-2?
11. Приведите уравнения реакций полимеризации: а) винилхлорида СН2=СНСl; б) стирола С6Н5-СН=СН2. Сколько σ- и π-связей в молекуле винилхлорида?
Сопряжённые алкадиены
Цель: изучить строение, способы получения, химические свойства алкадиенов
План лекции
1. Строение алкадиенов
2. Способы получения
3. Химические свойства
Алкадиены (диены) – непредельные алифатические углеводороды, молекулы которых содержат две двойные связи. Общая формула алкадиенов СnH2n-2
Свойства алкадиенов в значительной степени зависят от взаимного расположения двойных связей в их молекулах. По этому признаку различают три типа двойных связей в диенах: 1) изолированные двойные связи разделены в цепи двумя или более s-связями - СН2=СН–СН2–СН=СН2 (разделенные sp3 -атомами углерода, такие двойные связи не оказывают друг на друга взаимного влияния и вступают в те же реакции, что и двойная связь в алкенах); 2) кумулированные двойные связи расположены у одного атома углерода - СН2=С=СН2 (подобные диены (аллены) менее стабильны, чем другие диены и при нагревании в щелочной среде перегруппировываются в алкины); 3) сопряжённые двойные связи разделены одной s-связью - СН2=СН–СН=СН2. Сопряжённые диены представляют наибольший интерес. Они отличаются характерными свойствами, обусловленными электронным строением молекул, а именно, непрерывной последовательностью четырех sp2 -атомов углерода. Все атомы углерода лежат в одной плоскости, образуя s-скелет. Негибридизованные р-орбитали каждого атома углерода перпендикулярны плоскости s-скелета и параллельны друг другу, взаимно перекрываются, образуя единое p-электронное облако. Такой особый вид взаимного влияния атомов называется сопряжением.
Перекрывание р-орбиталей имеет место не только между С1 – С2, С3 – С4, но и между С2 – С3. В связи с этим применяют термин: «сопряжённая система». Следствием делокализации электронной плотности является то, что длины связей С1 – С2 (С3 – С4) увеличены, по сравнению с длиной двойной связи в этилене (0,134 нм) и составляют 0,137 нм; в свою очередь, длина связи С3 – С4 меньше, чем в этане С – С (0,154 нм) и составляет 0,146 нм. Диены с сопряжённой системой двойных связей более энергетически выгодны.
По правилам IUPAC главная цепь молекулы алкадиена должна включать обе двойные связи. Нумерация атомов углерода в цепи проводится так, чтобы двойные связи получили наименьшие номера. Названия алкадиенов производят от названий соответствующих алканов (с тем же числом атомов углерода) с добавлением окончания – диен. Виды изомерии: 1) изомерия положения сопряжённых двойных связей; 2) изомерия углеродного скелета; 3) межклассовая с алкинами
Способы получения
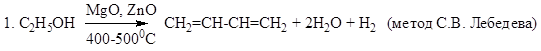
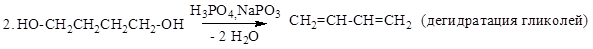
Химические свойства
Для сопряжённых диенов характерны реакции присоединения. Наличие сопряжённой системы p-электронов приводит к особенностям реакций присоединения. Сопряжённые диены способны присоединять не только по двойным связям (С1 и С2, С3 и С4), но и к концевым (С1 и С4) атомам углерода с образованием двойной связи между С2 и С3
1. CH2=CH-CH=CH2 + Br2 ®CH2Br-CH=CH-CH2Br + CH2Br-CHBr-CH=CH2 (присоединение галогенов) 1,4- присоединение 1,2- присоединение
Соотношение продуктов 1,2- и 1,4-присоединения зависит от температуры, при которой проводился эксперимент, и от полярности применяемого растворителя
2. CH2=CH-CH=CH2 + HBr ®CH3-CH=CH-CH2Br + CH3-CHBr-CH=CH2 (присоединение галогеноводородов) 1,4- присоединение 1,2- присоединение
3. n CH2=CH-CH=CH2  (-CH2-CH=CH-CH2-)n (полимеризация)
(-CH2-CH=CH-CH2-)n (полимеризация)
Полимеризация - важнейшее свойство сопряжённых диенов, которая происходит под действием различных катализаторов (AlCl3, TiCl4+(C2H5)3Al) или света. В случае применения определённых катализаторов можно получить продукт полимеризации с определённой конфигурацией цепей.

Цис-конфигурацию имеет натуральный каучук. Макромолекулы натурального каучука имеют спиралевидную структуру цепи из-за того, что изопреновые звенья изогнуты, что создаёт пространственные препятствия упорядоченному расположению цепей. В каучуке длинные молекулы скручены в спутанные друг с другом спирали. При растяжении каучука спирали растягиваются, а при снятии напряжения они снова скручиваются. В природе существует ещё другой полимер изопрена гуттаперча (транс-конфигурация). Гуттаперча обладает стержнеобразной структурой цепи из-за выпрямленности изопреновых звеньев (цепи с транс-конфигурацией двойных связей могут располагаться одна вдоль другой), поэтому гуттаперча твёрдый, но хрупкий полимер. Натуральный каучук имеют немногие страны и поэтому его заменяют синтетическими каучуками из дивинила, а также из изопрена.