ВНУТРЕННЯЯ ЭНЕРГИЯ
Под внутренней энергией термодинамической системы понимают кинетическую энергию теплового движения ее молекул и потенциальную энергию их взаимодействия. Она зависит от параметров состояния V,T. Внутренняя энергия идеального одноатомного газа прямо пропорциональна его абсолютной температуре:
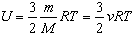
Для газов, состоящих из более сложных молекул, также U ~ Т, но коэффициент пропорциональности другой. Это объясняется тем, что такие молекулы не только движутся поступательно, но и вращаются.
РАБОТА В ТЕРМОДИНАМИКЕ
Если газ расширяется при постоянном давлении р, то сила, действующая со стороны газа на поршень: F = рS, где S - площадь поршня.

При подъеме поршня на высоту  газ совершает работу
газ совершает работу

где ΔV - изменение объема газа.
При медленном сжимании газа работа, совершаемая внешними телами над газом, будет отличаться только знаком:


Работа, совершаемая термодинамической системой при постоянном давлении, равна
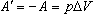
КОЛИЧЕСТВО ТЕПЛОТЫ
Процесс передачи энергии от одного тела к другому без совершения работы называют теплообменом.
Количество теплоты - это энергия, переданная телу в результате теплообмена.
Теплоемкость С - количество теплоты, необходимое для нагревания тела массой m на 1 К. Удельная теплоемкость с - это количество теплоты, которое получает или отдает 1 кг вещества при изменении его температуры на 1 К: c=C/m
Для изменения температуры вещества массой m от Т1 до Т2 ему необходимо сообщить количество теплоты

Коэффициент с в этой формуле называют удельной теплоемкостью: [с]=1 Дж/(кг*К).
При нагревании тела Q > 0, при охлаждении Q < 0.
Для того, чтобы жидкость массы m полностью превратить в пар, ей необходимо передать количество теплоты
Q=rm
где r - удельная теплота парообразования: [r] = 1 Дж/кг.
Удельная теплота парообразования - это количество теплоты, которое необходимо для превращения 1 кг жидкости в пар при постоянной температуре.
Конденсация - процесс, обратный испарению.
Для того, чтобы расплавить полностью тело массой m, ему необходимо сообщить количество теплоты
Q= λm
где - удельная теплота плавления: {λ} = 1 Дж/кг.
Удельная теплота плавления - это количество теплоты, которое необходимо для плавления 1 кг кристаллического вещества при температуре плавления.
Кристаллизация - процесс, обратный плавлению.
Для замкнутой системы, состоящей из N тел, можно записать уравнение теплового баланса:
Q1+...+Qn=0
где Q1,..., Q N - количества теплоты, полученные или отданные телами.
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Закон сохранения энергии
Энергия не возникает из ничего и не исчезает, она только переходит из одной формы в другую. Закон сохранения энергии, распространенный на тепловые явления, называется первым законом термодинамики.
Первый закон термодинамики
Изменение внутренней энергии системы при переходе из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:

Этот закон можно сформулировать иначе:
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами:

В первой формулировке А - работа, совершаемая над системой (над газом), во второй А' - это работа, совершаемая системой (газом).
Вечный двигатель первого рода - устройство, способное совершать неограниченное количество работы без подведения энергии извне.
Из первого закона термодинамики следует невозможность создания вечного двигателя первого рода. Если к системе не поступает теплота, то

Иными словами, работа совершается системой за счет уменьшения ее внутренней энергии. После того, как запас энергии будет исчерпан, двигатель перестанет работать.
Процесс, протекающий в теплоизолированной системе, называют адиабатным.
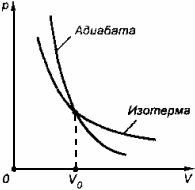
Абсолютно исключить теплопередачу невозможно, но иногда реальные процессы близки к адиабатным. Они протекают за очень малый промежуток времени, в течение которого не происходит существенного теплообмена между системой и внешними телами.