Цель работы: провести реакции внутримолекулярного окисления – восстановления и диспропорционирования.
Оборудование и реактивы: пробирки, пипетки, резиновая груша, стеклянные стаканы, спиртовка, дистиллированная вода, кристаллический перманганат калия (KMnO4), концентрированные соляная, серная, азотная кислоты (HCl, H2SO4, HNO3), иодид калия (KI), 0,1Н раствор перманганат калия (KMnO4), 10% и 0,1Н раствор серной кислоты (H2SO4), 10% и концентрированный раствор гидроксида натрия (NaOH), раствор сульфита натрия (Na2SO3), гранулы цинка (Zn), медная стружка (Cu), дихромат аммония ((NH4)2Cr2O7), нитрит натрия (NaNO2), сульфат марганца (MnSO4).
Теоретическая часть:
Реакции внутримолекулярного окисления-восстановления – это процесс изменения степени окисления атомов, находящихся в составе одной частицы.
Реакции диспропорционирования – это процессы, сопровождающиеся одновременным увеличением и уменьшением степени окисления данного вида атома.
Практическая часть:
1) В препараторской нам выдали пробирку с небольшим количеством бихромата аммония;
2) Нагрели пробирку на пламени спиртовки – произошло возгорание содержимого пробирки и появление зелёных хлопьев.
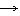 (NH4)2Cr2O7 Сr2O3 + N2 ↑ + 4H2O
(NH4)2Cr2O7 Сr2O3 + N2 ↑ + 4H2O
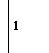
 окислитель Cr+6 +3
окислитель Cr+6 +3 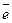 Cr+3
Cr+3
 восстановитель N-3 - 3
восстановитель N-3 - 3 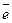 N0
N0
Такая реакция является примером реакции внутримолекулярного окисления – восстановления;
3) Налили в чистую пробирку 1 мл. йодной воды и 1 мл. концентрированного раствора гидроксида натрия, и нагревали пробирку на спиртовке - Наблюдаем обесцвечивание раствора;
 6I2 + 12NaOH 2NaIO3 + 10NaI + 6H2O
6I2 + 12NaOH 2NaIO3 + 10NaI + 6H2O
При обычных условиях образуется ион (IO)-, который очень не устойчив в растворе, поэтому он распадается на I- и (IO3)-
 3IO- 2I- + IO3-, поэтому образуются NaIO3 и NaI
3IO- 2I- + IO3-, поэтому образуются NaIO3 и NaI
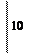
 окислитель 2I0 +2
окислитель 2I0 +2 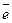 2I-
2I-
 восстановитель 2I0 + 12OH- - 10
восстановитель 2I0 + 12OH- - 10 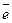 2(IO3)- + 6H2O
2(IO3)- + 6H2O
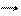 10I0 + 2I0 + 12OH- 10I- + 2(IO3)- + 6H2O
10I0 + 2I0 + 12OH- 10I- + 2(IO3)- + 6H2O
 |
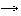 6I2 + 12NaOH 2NaIO3 + 10NaI + 6H2O:2
6I2 + 12NaOH 2NaIO3 + 10NaI + 6H2O:2
 3I2 + 6NaOH NaIO3 + 5NaI + 3H2O
3I2 + 6NaOH NaIO3 + 5NaI + 3H2O
4) В полученный раствор добавили небольшой избыток 0,1Н раствора серной кислоты – наблюдали окрашивание раствора в жёлто – коричневый цвет – выпадение йода, а так же наблюдали выделение пузырьков водорода;
 2NaI + H2SO4 Na2SO4 + I2 + H2
2NaI + H2SO4 Na2SO4 + I2 + H2

 восстановитель 2I- - 2
восстановитель 2I- - 2 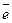 2I0
2I0
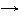 окислитель 2H+ + 2
окислитель 2H+ + 2 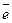 2H0
2H0
 2I- + 2H+ 2I0 + 2H0
2I- + 2H+ 2I0 + 2H0
5) В чистую пробирку налили 1 мл. 1Н раствора нитрита натрия и прилили 1 мл. 25% раствора серной кислоты – наблюдаем выделение бурого газа NO2 и бесцветного газа NO;
 2NaNO2 + H2SO4 Na2SO4 + NO ↑ + NO2 ↑ + H2O
2NaNO2 + H2SO4 Na2SO4 + NO ↑ + NO2 ↑ + H2O
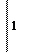
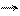 окислитель N+3 +1
окислитель N+3 +1 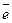 N+2
N+2
 восстановитель N+3 - 1
восстановитель N+3 - 1 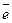 N+4
N+4
 N+3 + N+3 N+2 + N+4
N+3 + N+3 N+2 + N+4
Эта реакция является примером реакции диспропорционирования;

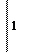 окислитель (NO2)- +2Н+ + 1
окислитель (NO2)- +2Н+ + 1 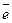 NO0 + H2O
NO0 + H2O
 восстановитель (NO2)- - 1
восстановитель (NO2)- - 1 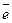 NO20
NO20
 (NO2)- +2Н+ + (NO2)- NO0 + H2O + NO20
(NO2)- +2Н+ + (NO2)- NO0 + H2O + NO20
6) Налили в пробирку 1 мл. 0,01Н раствор перманганата калия и добавили к нему 1 мл. сульфата марганца (II). Наблюдали изменение окраски раствора – бурый цвет, благодаря появлению оксида марганца (IV).
 2КMnO4 + 3MnSO4 + 2H2O 2H2SO4 + 5MnO2 ↓ + K2SO4
2КMnO4 + 3MnSO4 + 2H2O 2H2SO4 + 5MnO2 ↓ + K2SO4

 окислитель (MnO4)- + 4H+ +3
окислитель (MnO4)- + 4H+ +3 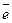 (MnO2)0 + 2H2О
(MnO2)0 + 2H2О
 восстановитель Mn2+ + 2H2O - 2
восстановитель Mn2+ + 2H2O - 2 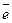 (MnO2)0 + 4H+
(MnO2)0 + 4H+
 2(MnO4)- + 8Н+ + 3Mn2+ + 6H2O 2(MnO2)0 + 4Н2О + 3(MnO2)0 + 12H+
2(MnO4)- + 8Н+ + 3Mn2+ + 6H2O 2(MnO2)0 + 4Н2О + 3(MnO2)0 + 12H+
Данная реакция представляет реакцию, обратную диспропорционированию, когда атомы, находившиеся в разной степени окисления, превращаются в частицу, с одинаковой степенью окисления.
Вывод: Были рассмотрены внутримолекулярные реакции разложения, а также реакции диспропорционирования.