Нижегородский государственный университет им. Н.И.Лобачевского
 |
Химический факультет
Кафедра неорганической химии
Техника проведения лабораторных работ
Отчёт лабораторной работы
Преподаватель:
Сибиркин А.А.
Выполнили студенты 213 (I) группы:
 Нижний Новгород 2006 г.
Нижний Новгород 2006 г.
Задания лабораторной работы:
1. Взвешивание.
2. Фильтрование и декантация.
3. Титрование.
4. Определение температуры плавления вещества.
Взвешивание
Цель работы: определить массу двух предметов на технических и на аналитических весах.
Оборудование: технохимические и аналитические весы, набор разновесов, два предмета для взвешивания.
Ход работы
1. Теоретическая часть
Взвешивание проводится для того, чтобы определить массу предметов. Взвешивать можно на технохимических и на аналитических весах. На технохимических весах можно взвесить предмет массой от 0,01 до 200,0 г. На аналитических от 0,0001 г. Взвешивание является наиболее распространённой операцией при выполнении лабораторных работ по общей и неорганической химии.
2. Практическая часть
Для взвешивания на технических весах был выдан предмет (фарфоровая ёмкость на 50 мл) и набор разновесов. До начала работы нужно было проверить исправность весов, для этого поворотом арретира весы были приведены в рабочее состояние и было проверено, куда отклоняется стрелка от положения равновесия. После этого весы обратно были приведены в нерабочее состояние и на левую чашку весов был помещён предмет. В ходе взвешивания на правой чашке весов оказались по очереди гирьки массами по 20, 10, 2, 2 грамма и по 200, 200, 90 мг соответственно. Когда весы уравновесились, был произведён подсчёт массы предмета по массам гирек:
20 г +10 г +2 г +2 г +0,2 г +0,2 г +0,09 г = 34,49 г.
Для взвешивания на аналитических весах был выдан другой предмет (крышка). До начала взвешивания было также проверена исправность весов. После этого на левую чашку весов был помещён предмет, а на правую гирьки. В ходе взвешивания на ней оказались две гирьки массой по 2 грамма. Но массы гирек было недостаточно, чтобы уравновесить весы, тогда нам пришлось вращать лимбы. Лимбы укреплены в верхнем правом углу витрины весов. При вращении малого (внутреннего) лимба на правое коромысло весов помещаются или снимаются гири достоинством в сотые доли грамма, при вращении большого (внешнего) лимба – десятые доли грамма. На лимбах имеются цифры, указывающие количество десятых и сотых долей грамма, для отсчёта величины навески. Внешний лимб был установлен на отметке цифрой 3, что означает 300 мг, а внутренний лимб на отметке с цифрами 00. После этого, когда установились весы, микрошкала, которая показывает отклонения от 0 до 0,001 г в обе стороны, остановилась на правой части шкалы между на первом делении между числами +3 и +4. Отсюда следует, что масса предмета оказалась равной:
2 г +2 г +0,3 г +0,0031 г =4,3031 г.
После окончания работы все весы были приведены в нерабочее положение.
3. Теоретическое обоснование
В результате взвешивания на технохимических и на аналитических весах были установлены массы двух предметов. Эти массы совпали с реальными, которые были даны в препараторской.
Фильтрование и декантация
Цель работы: провести синтез, фильтрование, отмывку декантацией осадка карбоната кальция CaCO3.
Оборудование и реактивы: колба для синтеза, колба для фильтрования и декантации, стеклянная воронка, фильтровальная бумага, дистиллированная вода, раствор Na2CO3 0,5 н., раствор CaCl2 1 н.
Ход работы.
1. Теоретическая часть
Для отделения жидкости от находящихся в ней твёрдых примесей применяют фильтрование. В качестве фильтра применяют фильтровальную бумагу различной плотности. Часто осадок нужно отмывать от растворимых примесей, которые задерживаются частицами отфильтрованного осадка. С этой целью используют операцию декантации.
2. Практическая часть
В колбу было помещено несколько миллилитров хлорида кальция CaCl2, затем был прилит избыток Na2CO3. Согласно реакции, выпадает белый мелкокристаллический осадок CaCO3:
CaCl2 + Na2CO3 ® CaCO3¯ + 2NaCl
Затем был приготовлен фильтр из фильтровальной бумаги, как показано на рисунке 1.
 рис. 1
рис. 1
Готовый фильтр был вставлен в воронку для фильтрования и через него был отфильтрован осадок CaCO3. После фильтрования осадок был разбавлен дистиллированной водой. Затем, когда осадок отстоялся и осел на дно колбы, была проведена декантация или слив жидкости над осадком. Подобная операция была проведена 4 раза.
3. Теоретическое обоснование
Синтез, фильтрование, декантация осадка CaCO3 было проведено успешно. Преподаватель одобрил все проведённые операции.
Титрование
Цель работы: определить концентрацию кислоты или щёлочи и рассчитать доверительный интервал концентрации.
Оборудование и реактивы: бюретка, пипетка на 10 мл с грушей, колбы, раствор щёлочи (раствор, концентрацию которого нужно определить), раствор HCl 0,1 н., индикатор фенолфталеин.
Ход работы
1. Теоретическая часть
Чтобы определить концентрацию растворов применяют метод титрования. Титрование представляет собой лабораторный приём при определении концентрации раствора одного из реагирующих веществ по известной концентрации раствора другого реагирующего вещества путём измерения объёмов вступающих в реакцию растворов этих веществ, т.е. этот приём позволяет определить титр раствора интересующего вещества, если известен титр раствора вступающего в реакцию другого вещества. При титровании пользуются мерной посудой, а именно: мерным цилиндром, бюретками и пипетками.
2. Практическая часть
В препараторской был выдан раствор щёлочи, концентрацию которого нужно определить. Пипеткой было отобрано 10 мл этого раствора и перелито в чистую колбу. После к отобранному раствору было добавлено несколько капель индикатора фенолфталеина, раствор приобрёл малиновую окраску. Затем в бюретку для титрования была налита кислота (HCl 0,1 н.) до нулевой отметки и мы по каплям начали сливать эту кислоту в колбу с раствором щёлочи до тех пор, пока он не обесцветился. Объём прилитой кислоты составил 19 мл. Такая операция была проведена четыре раза. Во втором опыте кислоты составил 18,8 мл, в третьем – 18 мл, в четвёртом – 19,2 мл. Исходя из полученных результатов, была определена концентрация щёлочи:

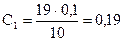 н.;
н.; 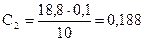 н.;
н.;  н.;
н.;  н.
н.
С1, С2, С3, С4 – нормальные концентрации щёлочи.
Определение доверительного интервала титрования:
Х1 = 0,19; Х2 = 0,188; Х3 = 0,18; Х4 = 0,192
 , где n=4, т.к. опытов было 4.
, где n=4, т.к. опытов было 4.


t = 3,18


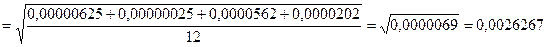

Пусть Х = 0,1875, DХ = 0,0083529, тогда Х + DХ = 0,19 ± 0,008.
3. Теоретическое обоснование
В результате титрования была определена концентрация щёлочи. Она совпала с той концентрацией, которую дал дежурный инженер. Также был определён доверительный интервал концентрации.
Определение температуры плавления вещества
Цель работы: определить температуру плавления неизвестного вещества.
Оборудование и реактивы: колба с глицерином, пробирка, термометр, капилляр, песчаная баня, неизвестное вещество.
Ход работы
1. Теоретическая часть
Определение температуры плавления производят с помощью прибора, изображённого на рисунке 2:
 рис. 2
рис. 2
2. Практическая часть
В препараторской было выдано вещество, у которого нужно определить температуру плавления. Небольшая часть этого вещества была помещена в капилляр, и с помощью резинового кольца этот капилляр был прикреплён к термометру. Затем был собран прибор, как показано на рис. 2. Прибор был установлен на песчаную баню. Через некоторое время была зафиксирована температура, при которой вещество расплавилось. Она составила 125°С. Для более точного получения результата, опыт был проведён ещё один раз. На этот раз температура составила 127°С.
3. Теоретическое обоснование
В результате опыта была определена температура плавления неизвестного вещества. Она оказалась равной 127°С. Эта величина совпала с той, которую нам сказал дежурный инженер.
Список литературы:
1. Ю.Е. Еллиев, Ю.Б. Зверев Основы техники проведения лабораторных работ.
2. Ю.Е. Еллиев, Ю.Б. Зверев Методы очистки веществ.