I.Простые углеводы (моносахариды или монозы)
Эти углеводы не подвергаются гидролизу с образованием более простых углеводов. Моносахариды в зависимости от числа атомов углерода в молекуле разделяют на тетрозы (С4), пентозы (С5), гексозы (С6) и т.д. В зависимости от того, имеется ли в молекуле альдегидная или кетонная группа, их делят на альдозы и кетозы.
II.Сложные углеводы (полисахариды или полиозы)
Эти углеводы подвергаются гидролизу с образованием простых углеводов. Среди сложных углеводов различают низкомолекулярные, сахароподобные (олигосахариды), содержащие в молекуле от двух до десяти остатков моноз и высокомолекулярные, несахароподобные (высшие полисахариды), содержащие более 10 остатков моноз. Среди олигосахаридов различают восстанавливающие (восстанавливают катионы Сu2+ и Аg+) и невосстанавливающие. Высшие полисахариды делят на две группы: гомополисахариды, состоящие из остатков одного и того же моносахарида, и
Гетерополисахариды, состоящие из остатков различных моносахаридов.
Сказанное можно представить в виде следующей схемы:

Из простых углеводов наибольшее значение имеют пентозы (рибоза, 2-дезоксирибоза, арабиноза, ксилоза) и гексозы (глюкоза, манноза, галактоза, фруктоза). Среди олигосахаридов наиболее распространены и важны дисахариды (сахароза, лактоза, мальтоза, целлобиоза). Самыми известными представителями высших полисахаридов являются крахмал и целлюлоза (клетчатка).
МОНОСАХАРИДЫ
Строение, изомерия моносахаридов. Строение моносахаридов рассмотрим на примере глюкозы. Её состав С6Н12О6. Структурная формула:

В молекуле глюкозы четыре асимметрических атома углерода (помечен- ных звёздочкой), каждый из которых связан с четырьмя различными замести- телями. У соединения с подобной структурной формулой должно существовать 24=16 стереоизомеров, среди которых будет восемь пар оптических антиподов (энантиомеров), являющихся зеркальным отражением друг друга. Одну из восьми пар составляют D- и L-глюкоза. Строение опти- ческих изомеров можно показать, используя проекционные формулы Э.Фишера. При написании подобных формул проводят вертикальную черту и столько горизонтальных, сколько асимметрических атомов углерода. В местах пересечения вертикальной и горизонтальной черт находятся асимметрические атомы углерода, которые обычно не пишут. Над вертикальной чертой принято писать альдегидную группу (а у кетоз первич- ную спиртовую, рядом с которой находится карбонильная группа). На концах горизонтальных черт будут находиться Н и ОН. При таком изображении формулы D- и L-глюкозы имеют вид:

| 
|
| D -глюкоза | L -глюкоза |
Углеродные атомы нумеруют с того конца цепи, к которому ближе расположена карбонильная группа. Принадлежность к D- или L-ряду определяется по положению гидроксильной группы у наиболее удаленного от карбонильной группы асимметрического атома углерода. Если гидроксил справа, то изомер относится к D-ряду; слева – к L-ряду. Проекционные формулы могут ещё упрощаться.
Например:

| 
| или | 
| 
|
| D -глюкоза | L -глюкоза | D -глюкоза | L -глюкоза |
Кроме глюкозы имеется ещё семь альдогексоз: галактоза, манноза, аллоза, альтроза, гулоза, идоза и талоза. Все 16 изомеров в настоящее время известны и получены либо синтетическим путем, либо выделены из природных источников. Другие моносахариды могут отличаться от глюкозы числом углеродных атомов, иметь кетонную группу вместо альдегидной (например, фруктоза), а также иную конфигурацию асимметрических центров. Приведём формулы важнейших моносахаридов.
Альдо- и кетогексозы:

| 
| 
| 
|
| D -глюкоза | D -манноза | D -галактоза | D -фруктоза |
Альдопентозы:

| 
| 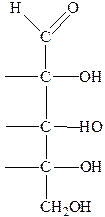
| 
|
| D -арабиноза | D -ксилоза | D -рибоза | 2-дезокси- D -рибоза |
Оптические изомеры, не являющиеся зеркальным отражением друг друга, называются диастереомерами. Например: D-глюкоза, D-манноза и D- галактоза – диастереомеры. Диастереомеры, различающиеся расположением заместителей только у второго углеродного атома (у первого асимметрического), называются эпимерами. Ими являются D-глюкоза и D- манноза, а у пентоз – D-арабиноза и D-рибоза.
Некоторые свойства моносахаридов не могут быть объяснены формулой альдегидоспирта или кетоноспирта. Так, глюкоза вступает не во все характерные для альдегидов реакции, например, она не образует гидросульфитного соединения, не даёт окрашивания с фуксинсернистой кислотой. Оказалось также, что не все гидроксильные группы глюкозы имеют одинаковые химические свойства. Одна гидроксильная группа отлича- ется повышенной реакционной способностью. Также нельзя объяснть, почему у свежеприготовленных растворов глюкозы и других моносахаридов наблюдается постепенное изменение значения удельного вращения до некоторой определенной постоянной величины. Это явление называется мутаротация.
Свойства глюкозы, которые не могут быть объяснены при рассмотрении её открытой или цепной формы, находят объяснение, если придать ей циклическую форму, которую также называют оксидной или полуацетальной. Эти две формы (цепная и циклическая) являются таутомерными и способны самопроизвольно переходить одна в другую в водных растворах.
Циклические формы могут иметь пяти- и шестичленные циклы (преобла- дают в растворе формы с более устойчивым шестичленным циклом).
Пятичленный цикл (γ-оксидный) называют фуранозным (от названия пятичленного гетероцикла фурана), а шестичленный (δ-оксидный) – пиранозным (от названия шестичленного гетероцикла – пирана). Замыкание шестичленного цикла происходит при переходе атома водорода гидроксильной группы, принадлежащей пятому атому углерода у альдоз или шестому у кетоз, к кислороду карбонильной группы по схеме:

| ||
| b, D- глюкопираноза | D- глюкоза | α, D- глюкопираноза |
Такой переход облегчается тем, что, во-первых, карбонильная группа поляризована, а, во-вторых, углеродная цепь молекул монозы в пространстве изогнута таким образом, что один из перечисленных гидроксилов находится рядом с кислородом карбонильной группы.
При замыкании кольца возникает кислородный мостик и образуется новый гидроксил – полуацетальный или гликозидный Он отличается от других гидроксильных групп повышенной реакционной способностью, так как находится у атома углерода, имеющего две связи с атомами кислорода, что приводит к поляризации связи О-Н и увеличению подвижности атома водорода.
При замыкании кольца углеродный атом карбонильной группы становит-ся асимметрическим, при появлении в молекуле нового асимметрического центра заместители Н и ОН могут расположиться двояким способом, что приводит к образованию из одной цепной формы двух циклических. Цикли- ческие диастереомеры, отличающиеся друг от друга только положением в пространстве полуацетального гидроксила, называются аномерами и обозначаются буквами α или β. Если полуацетальный гидроксил располагается с той же стороны, что и гидроксил, определяющий принадлежность к D- или L- ряду, то это α-аномер. А если наоборот, то β-аномер.
Иначе говоря, для веществ D-ряда в случае α-аномера полуацетальный гидроксил располагается справа, для β-аномера – слева. Для веществ L-ряда –наоборот. Замыкание кольца приводит к увеличению числа стереоизомеров в два раза, т.к. в молекуле глюкозы будет уже не четыре, а пять асимметричес-ких атомов углерода и число изомеров 25=32.
При образовании фуранозного (пятичленного) кольца к кислороду карбонильной группы присоединяется водород от гидроксила у четвёртого атома углерода альдоз и от гидроксила у пятого атома углерода кетоз.
Строение моносахаридов, меющих циклическую форму, очень удобно и наглядно изображать с использованием «перспективных» формул Хеуорзса. Такое изображение позволяет видеть взаимное расположение атомов водорода и гидроксильных групп относительно плоскости кольца. Кольца имеют форму правильных шести- и пятиугольников, расположенных перпен-дикулярно плоскости чертежа.
При написании шестичленного кольца кислород помещают в правый верхний угол. Через все углы, где находятся асимметрические атомы углерода (символы которых обычно опускают), проводят вертикальные чёрточки. Нумеруют атомы углерода по часовой стрелке (справа-налево). Заместители располагаются над и под кольцом соответственно с положени- ем их в проекционной формуле Фишера. Заместители, стоящие справа, пишут внизу цикла. А слева – вверху, за исключением тех, которые находят- ся у атома углерода, гидроксил которого участвует в замыкании кольца. Эти заместители располагают в обратном порядке.
Пятичленное кольцо изображают в виде пятиугольника у которого вверху две грани, в верхнем углу – атом кислорода, а внизу три грани (иногда три грани помещают вверх, при этом кислород находится в правом верхнем углу). Нумеруют атомы углерода и располагают заместители так же, как и в шестичленных кольцах.
Покажем это на приме глюкозы:

| 
|
| α, D- глюкопираноза | β, D- глюкофураноза |
В кристаллическом состоянии все моносахариды существуют только в виде циклических полуацеталей. В водном растворе между цепными и циклическими формами моноз устанавливается подвижное химическое равновесие – циклооксотаутомерия (ЦОТ). Приведём схему таутомерных превращений моносахаридов на примере D-глюкозы:
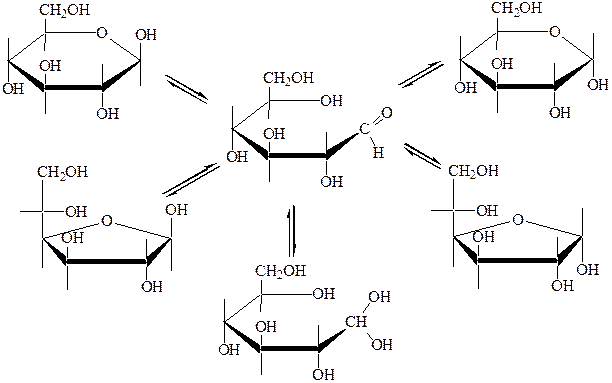 |
β,D-глюкопираноза α,D-глюкопираноза
(около 64%) (около 36%)
D-глюкоза
(0,024%)
β,D-глюкофураноза α,D-глюкофураноза
гидратная форма
D-глюкозы
Основной вклад в равновесие вносят циклические формы с пиранозным кольцом. Цепной формы с альдегидной группой в растворе очень мало, всего 0,024%. Это объясняет, почему не все реакции свойственные альдегидной группе протекают с раствором глюкозы.
Циклооксотаутомерия (цикло-цепная таутомерия) объясняет и такое явление, как мутаротация. Свежеприготовленный водный раствор α,D-глюко-пиранозы имеет удельное вращение [α]20 = +112˚, а β,D-глюкопиранозы - +18,7˚. Равновесная смесь этих аномеров имеет удельное вращение +52,7˚. Это значит, что в свежеприготовленном растворе α,D-глюкопиранозы удельное вращение будет уменьшаться, а в растворе β,D-глюкопиранозы – возрастать, пока не достигнет величины +52,7˚. Таким образом, в растворе аномеры переходят друг в друга пока не установится химическое равновесие. После установления равновесия в растворе содержится около 36% α,D-глю- козы и около 64% β,D-глюкозы (в основном глюкопиранозы).
Пиранозные формулы моноз условно изображают плоским шестичленным циклом, в действительности это кольцо, подобно кольцу циклогексана, может принимать различные пространственные формы (конформации).Большая часть молекул с пиранозным кольцом находится в наиболее устойчивой конформации «кресло». Причём для β,D-глюкопиранозы более устойчива структура, в которой все объёмные замести- тели (СН2ОН и ОН) занимают экваториальные положения:

β, D- глюкопираноза
Для α,D-глюкопиранозы наиболее устойчива конформация, в которой самая объёмная группа СН2ОН занимает экваториальное положение, например:

α, D- глюкопираноза
Из всех альдогексоз лишь β,D-глюкопираноза может принять конформацию, в которой все объёмные группы находятся в экваториальном положении. В метилированных и ацетилированных пиранозах объёмные группы также стремятся занять экваториальные положения; однако существует одно общее исключение: метокси- (-О-СН3) или ацетокси- (-ОСО-СН3) группы при первом атоме углерода стремятся занять аксиальное положение. Эо так называемый аномерный эффект, который объясняется тем, что диполь-дипольное отталкивание неподелённых электронов атома кислорода кольца и диполя связи С1-ОR сильнее в том случае, когда они параллельны, и убываетдля аксиального аномера.
Аномерный эффект

| |
| a-форма (более устойчивая) | b-форма (менее устойчивая) |
В результате аномерного эффекта равновесие сдвигается в сторону α-формы.
Физические свойства моносахаридов. Моносахариды – бесцветные, кристаллические вещества, хорошо растворимые в воде, сладкие на вкус. При нагревании до температур порядка 120-150˚С они разлагаются, превращаясь в прозрачную стеклообразную массу (образование карамели). Все они оптически активны.
Способы получение моносахаридов. В растениях углеводы образуются из диоксида углерода и воды в процессе фотосинтеза:

 Основным методом получения моносахаридов является гидролиз ди- и полисахаридов:
Основным методом получения моносахаридов является гидролиз ди- и полисахаридов:

Существуют и синтетические методы получения моносахаридов, однако они имеют чисто теоретическое значение.
1. Неполное окисление многоатомных спиртов. При окислении многоатомных спиртов могут получаться как альдозы, так и кетозы.
Например:

| ||
| шестиатомный спирт | альдогексоза | кетогексоза |
2. Циангидриновый синтез. Существенно важным для выяснения конфигурационного родства высших моносахаридов с низшими является циангидриновый синтез, основанный на присоединении синильной кислоты к альдегидной группе моноз. При присоединении НСN атом углерода альдегидной группы становится асимметрическим, заместители (Н и ОН) у этого углерода могут расположиться двояким способом. Следовательно, образуются два соединения отличающиеся конфигурацией у первого асимметрического атома углерода. Дальнейший гидролиз оксинитрилов приводит к образованию альдоновых кислот, лактоны которых легко восстанавливаются (например, амальгамой натрия) до моносахаридов. В качестве примера приведём превращение альдопентозы в альдогексозу.
|

D -глюкоза D -манноза
Таким образом, в результате синтеза образуются две эпимерные альдогексозы. Этот метод используют не только для установления конфигурации, но и для синтеза новых углеводов, в молекуле которых содержится на один атом углерода больше, чем в исходном моносахариде.
3. Синтез моносахаридов из оксимов моноз. При действии гидроксиламина на моносахариды получаются оксимы, которые при действии уксусного ангидрида могут отщеплять молекулу воды, образуя нитрилы. Последние при действии аммиачного раствора оксида серебра отщепляют молекулу синильной кислоты, образуя низшие монозы. Этот метод позволяет осуществить последовательный переход от высших моноз к низшим. Например:

| |||
| D- глюкоза | оксим D- глюкозы | нитрил глюконовой кислоты | D- арабиноза |
4. Альдольная конденсация. Конденсацией муравьиного альдегида под действием известковой или баритовой воды А.М.Бутлеров в 1861 г. Впервые получил густой сироп, содержащий смесь моносахаридов.

Химические свойства. Зная строение моносахаридов, легко понять их химические свойства. Мы рассмотрим эти свойства в основном на примере глюкозы и фруктозы. В зависимости от природы реагента в реакцию вступает либо цепная, либо циклическая форма моноз. Поскольку обе формы находятся в равновесии друг с другом, расходование одной из них в ходе реакции сдвигает таутомерное равновесие в сторону реагирующей формы. Таким образом, несмотря на малое содержание альдегидной формы, глюкоза может быть полностью превращена в производные этой формы.
Реакции цепной формы моносахаридов
1. Окисление. Моносахариды легко окисляются, причем в зависимости от условий получаются весьма разнообразные продукты окисления.
а) При осторожном окислении альдоз в кислой среде бромной или хлорной водой, разбавленной азотной кислотой получают одноосновные оксикислоты с тем же числом атомов углерода альдоновые (оновые) кислоты.

| |
| D -глюкоза | D -глюконовая кислота |
Кетозы в данных условиях не окисляются.
б) При более энергичном окислении альдоз, например, концентрирован- ной азотной кислотой, помимо альдегидной группы окисляется первичная спиртовая и образуются двухосновные оксикислоты, так называемые сахарные кислоты.
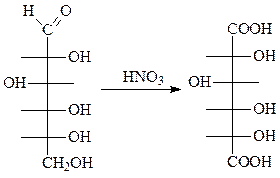
| |
| D -глюкоза | D -сахарная кислота (глюкаровая кислота) |
в) Если окислению подвергнуть простой эфир альдозы, образованный при участии полуацетального гидроксила (гликозид), то происходит окисление только первичной спиртовой группы в карбоксильную. После окисления гидролизом можно снова получить альдегидную группу, и тогда образуется полиоксиальдегидокислота. Такие альдегидокислоты называются уроновыми кислотами. Образование уроновых кислот происходит в печени животных.

D -глюкуроновая кислота
г) Все моносахариды – восстанавливающие сахара. Для них характерна реакция «серебряного зеркала» и взаимодействие с реактивом Фелинга или с Сu(ОН)2 при нагревании. Обычно при написании уравнений этих реакций показывают образование альдоновых кислот, например:

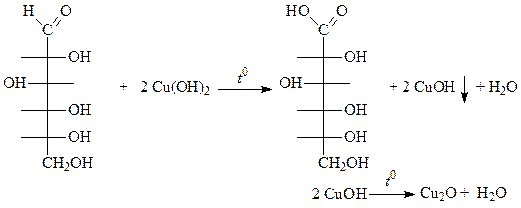
красный
В действительности реакции протекают сложно с образованием смеси продуктов. При окислении моносахаридов в щелочной среде происходит расщепление углеродного скелета с образованием ряда соединений, в том числе, очень легко окисляющихся. Например, из фруктозы могут образоваться продукты:

Этим объясняется, почему кетозы, в отличие от кетонов, вступают в эти качественные реакции.
Данное свойство кетоз можно объяснить и другим процессом, протекающим в щелочных растворах – эпимеризацией. В щелочных растворах (а в растениях под влиянием ферментов) из одного моносахарида образуется смесь трёх, двух эпимерных альдоз и соответствующей им кетозы. Превращение происходит через промежуточную ендиольную форму:
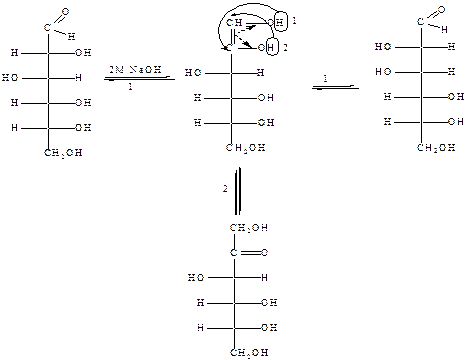 |
D-глюкоза ендиол D-манноза
D-фруктоза
Ендиол неустойчив и подвергается таутомерному превращению в соответствии с правилом Эльтекова. Как видно из схемы, при образовании альдоз из ендиола второй углеродный атом становится асимметрическим, следовательно заместители Н и ОН у него будут располагаться двояким способом, что и приводит к эпимерам. Подобные превращения могут претерпевать все моносахариды.
д) При жёстком окислении моносахаридов, например, раствором КМnО4 в кислой среде при нагревании образуются СО2 и Н2О, как и при горении:

2. Восстановление. Все моносахариды, подобно альдегидам и кетонам, при восстановлении образуют спирты. При восстановлении гексоз образуются шестиатомные спирты – гекситы. Так D-глюкоза при этом переходит в шестиатомный спирт – D-сорбит:

D-глюкоза D-сорбит
В качестве восстановителя используют водород в присутствии никеля, амальгамы щелочных металлов, боргидрид натрия и другие.
При восстановлении D-фруктозы образуются два изомерных шестиатомных спирта: D-сорбит и D-маннит, так как при превращении карбонильнойгруппы кетозы в спиртовую атом углерода становится асимметрическим.

| ||
| D -фруктоза | D -сорбит | D -маннит |
Сахарные спирты находят широкое применение. Сорбит является заменителем сахара в пище больных сахарным диабетом.
При использовании йодоводородной кислоты при нагревании моносахариды восстанавливаются до алканов или до йодпроизводных алканов. Например:

| |
| глюкоза | 2-йодгексан |
Данная реакция доказывает наличие неразветвлённой цепи из углеродных атомов в молекуле глюкозы.
3. Реакция с фенилгидразином. При нагревании глюкозы с избытком фенилгидразина сначала реагирует её альдегидная группа и образуется продукт замещения атома кислорода карбонильной группы на остаток фенил- гидразина (фенилгидразон). Вторая молекула фенилгидразина действует как окислитель, превращая соседнюю с бывшей альдегидной оксиметильную в карбонильную группу, которая реагирует обычным образом с третьей молекулой фенилгидразина, давая озазон глюкозы:

D-глюкоза фенилгидразон глюкозы
озазон
Озазоны моноз труднорастворимы в воде, хорошо кристаллизуются с образованием желтых кристаллов, форма и температура плавления которых позволяют установить, из какого углевода получен озазон. Это имеет важное значение для идентификации сахаров. При образовании озазона исчезает ближайший к карбонильной группе асимметрический центр, поэтому глюкоза, манноза и фруктоза образуют один и тот же озазон. Например, взаимодействие фруктозы с фенилгидразином протекает по схеме:
 |
D-фруктоза фенилгидразон фруктозы
озазон
4. Превращения под действием кислот. Отношение пентоз и гексоз к кислотам различно. При нагревании с минеральными кислотами пентоз от них отщепляется вода и образуется фурфурол:

| |
| пентоза | фурфурол |
Образовавшийся фурфурол легко обнаружить, например, при помощи реакции конденсации с анилином, дающей соединение красного цвета. При действии кислот на гексозы сначала образуется 5-оксиметилфурфурол, но он непрочен и при кипячении разлагается на левулиновую и муравьиную кислоты:
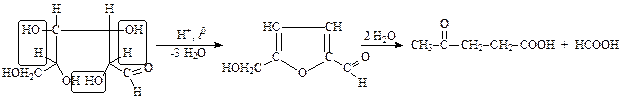
| ||
| гексоза | оксиметилфурфурол |
Реакции циклических форм моносахаридов
5. Качественная реакция с Сu(ОН)2. Как и другие органические соединения в молекулах которых содержатся две или более рядом расположенных гидроксильных групп, моносахариды вступают в качественную реакцию с гидроксидом меди (II). Например:

| ||
| комплексный глюкозат меди (II) |
При протекании реакции голубой осадок растворяется с образованием прозрачного синего раствора.
6. Алкилирование. Действие алкилирующих реагентов на моносахариды приводит к образованию неполных и полных простых эфиров.
а) Взаимодействие со спиртами. Со спиртами (слабыми алкилирующими реагентами) взаимодействует только полуацетальный (гликозидный) гидроксил; спиртовые (гликозные) гидроксилы в этой реакции не участвуют. В качестве катализатора используют газообразный хлороводород. В результате образуются гликозиды (ацетали).

| |
| a, D -глюкопираноза | метил-a, D -глюкопиранозид |
Гликозиды – производные моносахаридов, в которых водород полуацетального гидроксила замещён каким-либо остатком. Название гликозида строится от названия соответствующего моносахарида, при этом окончание –оза заменяется на –озид. Гликозиды в растворах существуют только в циклической форме, поэтому не вступают в реакции, протекающие при участии альдегидной группы, им не свойственна мутаротация.
Гликозиды гидролизуются кислотами и обычно стойки по отношению к щелочам. Гликозиды легко гидролизуются также под действием ферментов, носящих название гликозидаз. При гидролизе они распадаются на углевод и несахарную компоненту, носящую название агликона. Гликозиды часто встречаются в растениях. Роль агликона в них могут играть такие соединения, как фенолы, циангидрины и др. К гликозидам относятся, в частности, красящие вещества растений; сердечные гликозиды, обладающие сильным физиологическим действием; дубильные вещества. Примером может служить гликозид амигдалин С20Н27О11N, содержащийся в зернах горького миндаля и ядрах плодовых косточек. При гидролизе кислотами амигдалин распадается на углевод, бензойный альдегид и синильную кислоту:

б) При действии сильных алкилирующих реагентов (галогеналканов или диалкилсульфатов) атом водорода во всех гидроксильных группах замещается на алкил. Например:

| ||
| пентаэтил-a, D - глюкопиранозид | a, D -глюкопираноза | пентаметил-a, D - глюкопиранозид |
При кислотном или ферментативном гидролизе образующихся полных простых эфиров расщепляется только гликозидная связь. Это также доказывает особые свойства полуацетального гидроксила.

| |
| пентаметил-a, D - глюкопиранозид | тетраметил-a, D - глюкопиранозид |
Тетраметилглюкоза имеет в молекуле свободный полуацетальный гидроксил и может существовать в растворах в цепной и циклических формах, т.е. она способна к мутаротации, восстанавливает катионы серебра и меди и вступает в реакции, протекающие при участии альдегидной группы.
7. Ацилирование. При взаимодействии моносахаридов с ангидридами или галогенангидридами карбоновых кислот атом водорода всех гидроксильных групп замещается на ацил и образуются полные сложные эфиры. Например, при нагревании уксусного ангидрида с глюкозой образуется пентаацетилглюкоза:

Полные сложные эфиры способны к кислотному и щелочному гидролизу, однако и у них легче всего расщепляется связь, образованная полуацетальным гидроксилом.
8. Этерификация фосфорной кислотой. Важное биологическое значение имеют неполные фосфорнокислые эфиры моносахаридов и их производных. Так, фосфаты глюкозы и фруктозы являются промежуточными соединениями в процессах обмена углеводов клеточного дыхания, при брожении, синтезе крахмала и др. Наибольшее значение имеют следующие четыре фосфорнркислых эфира:

| 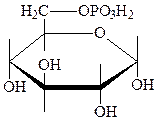
|
| 1-фосфат-a, D -глюкопираноза | 6-фосфат-a, D -глюкопираноза |

| 
|
| 1-фосфат-β, D -фруктофураноза | 1,6-дифосфат-β, D -фруктофураноза |
Реакции брожения
Многие моносахариды под влиянием ферментов, вырабатываемых некоторыми микроорганизмами, способны претерпевать химические превращения, известные под названием брожений. Видов брожения много, наиболее известны и важны – спиртовое, молочнокислое, лимоннокислое и маслянокислое. Брожению подвергаются гексозы, для пентоз эти реакции не характерны. Легче подвергаются брожению моносахариды D-ряда, т.е. те, которые встречаются в природе.
1. Спиртовое брожение вызывается дрожжевыми грибами различных рас. При этом глюкоза, фруктоза и некоторые другие гексозы разлагаются до этанола и СО2. Процесс можно суммарно выразить уравнением:

2. Молочнокислое брожение вызывается многими бактериями. В промышленности молочную кислоту полуают сбраживанием сахаров чистыми культурами бактерий Bacillus delbruckii. Чаще других моносахаридов для получения молочной кислоты используется глюкоза. В общем виде реакцию молочнркислого брожения можно представить так:

3. Лимоннокислое брожение происходит под влиянием плесневых грибов в присутствии кислорода воздуха. Этому брожению подвергаются многие моносахариды, при этом происходит изомеризация углеродного скелета молекулы сахара:
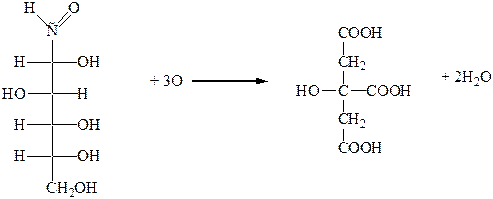
D-глюкоза лимонная кислота
4. Маслянокислое брожение происходит под влиянием многих анаэробных бактерий:

Кроме указанных в уравнении продуктов, при маслянокислом брожении получаются также в качестве побочных веществ этанол, уксусная, молочная, муравьиная кислоты и др.
Возможны и другие виды брожения сахаров, в результате которых получаются различные продукты. Например, глицериновое, ацетоно-бутано- ловое, ацетоно-этаноловое и др.
Аминосахара.
Широко распространены в природе аминосахара. Все природные аминосахара при втором атоме углерода вместо гидроксила содержат аминогруппу. Наиболее известны 2-дезокси-2-амино-D-глюкопираноза (называемая также глюкозамином или хитозамином) и 2-дез- окси-2-амино-D-галактопираноза, или хондрозамин:

| 
|
| Хитозамин | Хондрозамин |
Хитозамин является структурной единицей полисахарида хитина и муко- сахаридов. Остаток хондрозамина входит в состав полисахаридов хрящей.
Контрольные вопросы и упражнения к теме «Моносахариды»
1. Какие виды структурной и пространственной изомерии характерны для моносахаридов?
2. Составьте проекционные формулы всех оптических изомеров альдопентоз (нециклического строения). Какие из них являются оптическими антиподами, диастереомерами, эпимерами?
3. Напишите проекционные формулы моносахаридов: 1) D- и L-фруктозы, 2) D- и L-галактозы, 3) D- и L-рибозы. Что обозначают символы D- и L- перед названием моносахарида?
4. Какие моносахариды называют эпимерными? Составьте проекционные формулы моноз, эпимерных D-глюкозе, D-галактозе, D-ксилозе.
5. Приведите схему эпимеризации D-рибозы.
6. Что такое циклооксотаутомерия? Покажите это на примере D-рибозы с использованием проекционных и перспективных формул.
7. Составьте схему таутомерных превращений D-фруктозы, пользуясь перспективными формулами Хеуорзса и учитывая, что в растворе существуют как пиранозные, так и фуранозные формы.
8. Что такое аномеры? Какой из них α-, β -аномер?
9. Какой гидроксил называется полуацетальным? Какое ещё название он имеет?
10. Какое явление называют мутаротацией? Как объясняют это явление?
11. Какие свойства моносахаридов не могут быть объяснены с помощью одной цепной (карбонильной) формы?
12. Напишите перспективные формулы следующих соединений: 1) α- и β,D- рибопиранозы, 2) α - и β,D-рибофуранозы, 3) α - и β,D-маннопиранозы, 4) α – и β,D-2-дезоксирибофуранозы, 5) β-метил-D-глюкопиранозида, 6) 2,3,4,6-тетраацетил -β-этил-D-галактопиранозида.

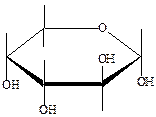 13. Назовите соединения:
13. Назовите соединения:
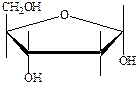 а) б) в)
а) б) в)


 г) д) е)
г) д) е)
14. Назовите соединения:
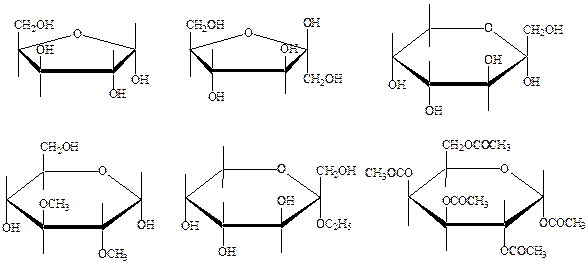 а)
а)
б) в)
г) д) е)
15. Напишите схемы кислотного гидролиза пентаацетил-α,D-глюкопиранозида и пентаметил-β,D-фруктофуранозида.
16. Напишите схему получения β,D-изопропилгалактопиранозида.
17. Получите озазон D-маннозы. Какие моносахариды дают такой же озазон?
18. Напишите уравнения реакций получения альдогептоз циангидриновым синтезом исходя из D-глюкозы.
19. Приведите схему превращения D-галактозы в соответствующую пентозу.
20. Напишите уравнения реакций согласно схеме:
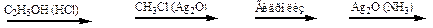 |
β,D-глюкопираноза A B C D
21. Составьте уравнения реакций согласно схеме:
 |
β,D-фруктофураноза A B C D
ДИСАХАРИДЫ
Дисахариды – это углеводы, молекула которых состоит из двух остатков моноз. Это могут быть остатки одного моносахарида или двух разных. По строению и по химическим свойствам дисахариды делят на два типа – восстанавливающие и невосстанавливающие. У восстанавливающих дисахаридов связь между остатками моноз образуется при участии полуацетального (гликозидного) гидроксила одной молекулы моносахарида и спиртового (гликозного) гидроксила другой молекулы моносахарида. Такую связь называют гликозид – гликозной. У этих дисахаридов сохраняется один с