Этиленовые и диеновые углеводороды. Основные понятия химии
Высокомолекулярных соединений.
Непредельные углеводороды.
Непредельными называются углеводороды, в молекулах которых имеются атомы углерода, связанные между собой двойными или тройными связями.
Этиленовые углеводороды. Алкены. Олефины.
Алкены – это углеводороды, в которых углеродные атомы затрачивают на соединение с соседним углеродным атомом две валентности (это углеводороды с двойной связью в цепи). Атомы углерода с двойной связью находятся в состоянии sp2-гибридизации.
Общая формула соединений СnH2n
Названия строятся аналогично алканам, с заменой окончания –ан на – ен.
Родоначальник рода – этилен СН2=СН2.
Номенклатура.
1. Рациональная – название строится от первого представителя гомологического ряда (этилена), а каждый последующий представитель – называется как производное от него, заменой атомов водорода в этилене на алкильные радикалы.
2. Номенклатура ИЮПАК: пропан – пропен, этан – этен.
1) за главную цепь принимают самую длинную цепь, включающую двойную связь.
2) нумерацию цепи начинают с того конца, где ближе двойная связь
3) названия алкенов строятся от названий аналогичных алканов с заменой окончания –ан на –ен, цифрой показывают положение кратной связи
4) количество и положение заместителей показывается приставками и цифрами аналогично алканам
Непредельные углеводородные радикалы называют, добавляя к корню суффикс – енил.
Строение алкенов
Атомы углерода в алкенах находятся в sp2-гибридном состоянии. Двойная связь состоит из однойs- и одной p-связи.
Известно, чтоp-связь менее прочная, вследствие перекрывания электронных облаков вне плоскости молекулы.
|
|
В гибридизации участвуют 1s- и 2p-электронных облака
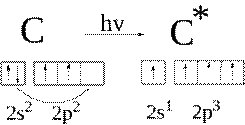

Молекула этилена будет выглядеть следующим образом:
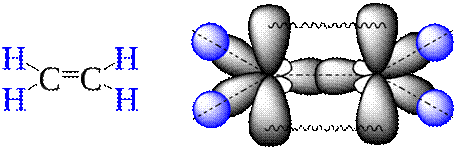
Валентный угол – 1200
Форма – плоский треугольник
Длина С=С связи – 0.134 нм
Е св = 611 кДж
Изомеры алкенов
1) Структурная изомерия - изомерия углеродного скелета
СН3 – СН2 - СН=СН2® СН3 – СН2 =СН – СН3
бутен-1 бутен-2
2) Изомерия положения кратной связи
СН3 – СН2 - СН=СН2 ® 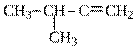
бутен-1 2-метилбутен-1
3) Цис-транс-изомерия – если заместители находятся по одну сторону от С=С связи – это цис-изомер, если по разные – транс-изомер. из-за жестко закрепленной связи невозможно свободное вращение.

транс-бутен-2 цис-бутен-2
Физические свойства
Первые четыре представителя – газообразные вещества.
Олефины с числом атомов С5-С17 – жидкости, обладают малой растворимостью в воде.
Отдельные представители: этилен – б/цветн газ, со сладковатым запахом, легче воздуха, малорастворим в воде.
Алкены с нормальной цепью кипят при более высокой температуре, чем разветвленные. Перемещение С=С –связи в центр молекулы вызывает увеличение температуры кипения.
tкип норм>t кип разв
Цис-изомеры кипят при более высокой температуре, чем транс-изомеры.
tкип цис>t кип транс
Химические свойства алкенов
1. Реакции присоединения.
Химические свойства алкенов определяются наличием в их молекулах двойной связи. Под действием реагента двойная связь, а именно пи-связь, как менее прочная и более реакционноспособная, разрывается и к освободившимся валентностям двух соседних атомов углерода присоединяются «осколки» реагента:
|
|
С=С + АВ С—С
При этом двойная связь превращается в одинарную (простую, сигма- связь).
По этой схеме к двойным С=С-связям присоединяются:
1. Водород (H2) (р. гидрирования): Н2С=СН2 + Н2 Н3С—СН3
В результате реакции гидрирования алкены превращаются в алканы.
2. Галогены (Cl2, Br2) (р. галогенирования): Н2С=СН2 + Br2 Н2СBr—СН2Br
Реакция с бромной водой – качественная реакция на алкены (двойную связь), так как происходит обесцвечивание бромной воды.
3. Галогеноводороды (HCl, HBr) (р. гидрогалогенирования):
Н2С=СН2 + НBr Н3С—СН2Br
4. Вода (Н2О) (р. гидратации): Н2С=СН2 + Н2О Н3С—СН2ОН
Присоединение галогеноводородов и воды к алкенам несимметричного строения (например, к гомологам этена) идет по правилу Марковникова В.В.: «водород присоединяется к более гидрированному атому углерода, а галоген (гидроксильная группа) к менее гидрированному атому углерода при двойной связи»:
СН3--НС=СН2 + НBr Н3С—СН—СН3
5. Реакция полимеризации – химический процесс, при котором молекулы мономера присоединяются друг к другу, образуя молекулу полимера, без выделения побочных продуктов.
n Н2С=СН2---------- (-Н2С—СН2-)n
Получение алкенов
(отщепление)
Основные методы получения алкенов основаны на реакциях отщепления (де) от двух соседних атомов углерода каких либо других атомов или групп атомов.
1. Отщепление Н2 (дегидрирование алканов):
СН 3 —СН 3 Н2С=СН2+ Н2
2. Отщепление галогенов (Cl2, Br2) (дегалогенирование):
Н2С Br —СН2 Br + Zn Н2С=СН2 + ZnBr2
3. Отщепление галогеноводородов (HCl, HBr) (дегидрогалогенирование):
Н 3 С—СН2 Br + КОН Н2С=СН2+КBr+ Н2О
4. Отщепление воды (дегидратация спиртов):
|
|
При дегидратации вторичных и третичных спиртов и дегидрогалогенировании вторичных и третичных галогеноалканов отщепление атома водорода идет по правилу А.М. Зайцева: «водород отщепляется от того из соседних атомов углерода, который менее гидрирован »:
Н3С— СН2 —СН—СН3 Н3С—СН=СН—СН3+Н2О
Внимательно прочитайте, заранее проанализируйте, дайте правильный и обоснованный ответ.
1. Превращение бутана в бутен относится к реакции:
1) полимеризации 2) дегидрирования 3) дегидратации 4) изомеризации