Для вычисления термодинамических функций H°(T)-H°(0), S°(T), Ф°(Т), G°(Т)-G°(0) заданного вещества Мо, в интервале температур 100-500 К с шагом 25 К используем табличные значения термодинамических функций Ср(Т), S0(100) и H0(100)-H0(0), приведенные в источнике [1]. Расчет термодинамических функций при температурах 100, 200, 300, 400, 500 К производим по формулам из источника [2]:
а) изменение энтальпии
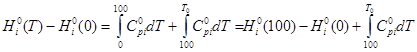 (1)
(1)
б) изменение энтропии 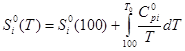 (2)
(2)
в) изменение энергии Гиббса 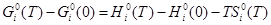 (3)
(3)
г) изменение приведенной энергии Гиббса:
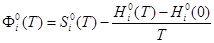 , (4)
, (4)
где:
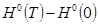 - высокотемпературная составляющая стандартной энтальпии;
- высокотемпературная составляющая стандартной энтальпии;
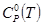 - значение стандартной теплоёмкости;
- значение стандартной теплоёмкости;
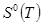 - стандартная энтропия индивидуального вещества при указанной температуре;
- стандартная энтропия индивидуального вещества при указанной температуре;
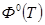 - приведённая энергия Гиббса;
- приведённая энергия Гиббса;
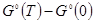 - разность стандартных энергий Гиббса при заданной температуре и при 0 К.
- разность стандартных энергий Гиббса при заданной температуре и при 0 К.
Для обеспечения точности вычисления термодинамических функций индивидуального вещества при указанных температурах с ошибкой не выше ~1%, стоградусный интервал, с которым приведены теплоемкости в источнике [1], разбивается на четыре равные части, и проводятся вычисления термодинамических функций 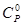 и
и 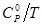 c шагом 25К, что достигается с помощью аппроксимации уравнений.
c шагом 25К, что достигается с помощью аппроксимации уравнений.
Выполнение расчетов термодинамических функций индивидуального вещества осуществляется с помощью специальной компьютерной программы в компьютерном классе.
Значение термодинамических функций C0(T) и C0(T)/T для индивидуального вещества Мо приведены в таблице 1.
Таблица 1 - Значение функций С0(Т) и С0(Т)/Т для Мо
| Т, К | С0(Т), Дж/моль* К | С0(Т)/Т |
| 13.5200 | 0.1352 | |
| 16.4035 | 0.1294 | |
| 18.6039 | 0.1226 | |
| 20.2560 | 0.1151 | |
| 21.4800 | 0.1074 | |
| 22.3808 | 0.0998 | |
| 23.0486 | 0.0926 | |
| 23.5582 | 0.0859 | |
| 23.9700 | 0.0799 | |
| 24.3289 | 0.0747 | |
| 24.6651 | 0.0702 | |
| 24.9938 | 0.0664 | |
| 25.3150 | 0.0633 | |
| 25.6140 | 0.0605 | |
| 25.8611 | 0.0508 | |
| 26.0113 | 0.0552 | |
| 26.0050 | 0.0520 |
Примечание: С0(Т) - теплоёмкость вещества, рассчитывается при P=const.
|
|
Таблица 2 - Значение функций H0(T)-H0(0),S0(T), Ф0(Т), G0(T)-G0(0) для Мо.
| Т,К | Н0(Т)-Н0(0), кДж/моль | S0(T), Дж/моль*К | Ф0(Т), Дж/моль*К | G0(T)-G0(0), кДж/моль |
| 0.4910 | 6.9970 | 2.0870 | -0.20870 | |
| 2.3147 | 19.2112 | 7.6376 | -1.52752 | |
| 4.6089 | 28.5049 | 13.1418 | -3.94255 | |
| 7.0748 | 35.5721 | 17.8850 | -7.15400 | |
| 9.6544 | 41.3582 | 22.0495 | -11.02474 |
Примечание:
Н0(Т)-Н0(0)-изменение энтальпии;
S0(T)-энтропия; Ф0(Т)-приведённая энергия Гиббса;
G0(T)-G0(0)-изменение энергии Гиббса.
Вывод: При вычислении термодинамических функций с помощью готовых программ мы показали, что ошибка в расчетах не превышает 1 %, в сравнении с приложением А [1]. Из результатов вычислений видно, что, так как функция 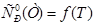 является возрастающей функцией температуры, то
является возрастающей функцией температуры, то 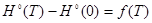 ,
,  являются возрастающими функциями температуры, что и следует из законов термодинамики
являются возрастающими функциями температуры, что и следует из законов термодинамики 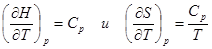 (графики 1-3).
(графики 1-3).
1.2 Описание химических свойств вещества Mo
Молибде́н - d элемент <https://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82>. Находится в побочной подгруппе шестой группы пятого периода периодической системы химических элементов <https://ru.wikipedia.org/wiki/%D0%9F%D0%B5%D1%80%D0%B8%D0%BE%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0_%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D1%85_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2> Д. И. Менделеева <https://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D0%BD%D0%B4%D0%B5%D0%BB%D0%B5%D0%B5%D0%B2,_%D0%94%D0%BC%D0%B8%D1%82%D1%80%D0%B8%D0%B9_%D0%98%D0%B2%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%87>, атомный номер <https://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BE%D0%BC%D0%BD%D1%8B%D0%B9_%D0%BD%D0%BE%D0%BC%D0%B5%D1%80> 42. Обозначается символом Mo (лат. <https://ru.wikipedia.org/wiki/%D0%9B%D0%B0%D1%82%D0%B8%D0%BD%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA> Molybdaenum). Электронная формула: 1s 22s 22p 63s 23p64s 23d104p65s14d5.
|
|
Простое вещество <https://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%BE%D1%81%D1%82%D0%BE%D0%B5_%D0%B2%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%BE> молибден - переходный <https://ru.wikipedia.org/wiki/%D0%9F%D0%B5%D1%80%D0%B5%D1%85%D0%BE%D0%B4%D0%BD%D1%8B%D0%B5_%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB%D1%8B> металл <https://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D1%82%D0%B0%D0%BB%D0%BB> светло-серого цвета <https://ru.wikipedia.org/wiki/%D0%A6%D0%B2%D0%B5%D1%82>. Главное применение находит в металлургии <https://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D1%82%D0%B0%D0%BB%D0%BB%D1%83%D1%80%D0%B3%D0%B8%D1%8F>.
История и происхождение названия
Открыт в 1778 году <https://ru.wikipedia.org/wiki/1778_%D0%B3%D0%BE%D0%B4> шведским химиком Карлом Шееле <https://ru.wikipedia.org/wiki/%D0%A8%D0%B5%D0%B5%D0%BB%D0%B5,_%D0%9A%D0%B0%D1%80%D0%BB_%D0%92%D0%B8%D0%BB%D1%8C%D0%B3%D0%B5%D0%BB%D1%8C%D0%BC>, который, прокаливая молибденовую кислоту, получил МоО3 <https://ru.wikipedia.org/wiki/%D0%9E%D0%BA%D1%81%D0%B8%D0%B4_%D0%BC%D0%BE%D0%BB%D0%B8%D0%B1%D0%B4%D0%B5%D0%BD%D0%B0(VI)>. В металлическом <https://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D1%82%D0%B0%D0%BB%D0%BB> состоянии впервые получен П. Гьельмом в 1782 <https://ru.wikipedia.org/wiki/1782> г. восстановлением оксида углём: он получил молибден, загрязненный углеродом <https://ru.wikipedia.org/wiki/%D0%A3%D0%B3%D0%BB%D0%B5%D1%80%D0%BE%D0%B4> и карбидом <https://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D1%80%D0%B1%D0%B8%D0%B4> молибдена. Чистый молибден в 1817 году <https://ru.wikipedia.org/wiki/1817_%D0%B3%D0%BE%D0%B4> получил Й. Берцелиус <https://ru.wikipedia.org/wiki/%D0%91%D0%B5%D1%80%D1%86%D0%B5%D0%BB%D0%B8%D1%83%D1%81,_%D0%99%D1%91%D0%BD%D1%81_%D0%AF%D0%BA%D0%BE%D0%B1>.
Название происходит от др.-греч. <https://ru.wikipedia.org/wiki/%D0%94%D1%80%D0%B5%D0%B2%D0%BD%D0%B5%D0%B3%D1%80%D0%B5%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA> μόλυβδος, означающего «свинец». Оно дано из-за внешнего сходства молибденита <https://ru.wikipedia.org/wiki/%D0%9C%D0%BE%D0%BB%D0%B8%D0%B1%D0%B4%D0%B5%D0%BD%D0%B8%D1%82> (MoS2), минерала <https://ru.wikipedia.org/wiki/%D0%9C%D0%B8%D0%BD%D0%B5%D1%80%D0%B0%D0%BB> из которого впервые удалось выделить оксид <https://ru.wikipedia.org/wiki/%D0%9E%D0%BA%D1%81%D0%B8%D0%B4> молибдена, со свинцовым блеском <https://ru.wikipedia.org/wiki/%D0%93%D0%B0%D0%BB%D0%B5%D0%BD%D0%B8%D1%82> (PbS). Вплоть до XVIII <https://ru.wikipedia.org/wiki/XVIII> в. молибденит <https://ru.wikipedia.org/wiki/%D0%9C%D0%BE%D0%BB%D0%B8%D0%B1%D0%B4%D0%B5%D0%BD%D0%B8%D1%82> не отличали от графита <https://ru.wikipedia.org/wiki/%D0%93%D1%80%D0%B0%D1%84%D0%B8%D1%82> и свинцового блеска, эти минералы носили общее название «молибден».
|
|
Нахождение в природе.
Содержание в земной коре 3·10−4% по массе. В свободном виде молибден не встречается. В земной коре молибден распространён относительно равномерно. Молибден находится также в морской и речной воде, в золе растений, в углях и нефти. Молибден в породах находится в следующих формах: молибдатной и сульфидной в виде микроскопических и субмикроскопических выделений, изоморфной и рассеянной (в породообразующих минералах). Молибден обладает большим сродством с серой, чем с кислородом, и в рудных телах образуется сульфид четырёхвалентного молибдена - молибденит. Для кристаллизации молибденита наиболее благоприятны восстановительная среда и повышенная кислотность. В поверхностных условиях образуются преимущественно кислородные соединения Мо6+. В первичных рудах молибденит встречается в ассоциации с вольфрамитом и висмутином, с минералами меди (медно-порфировые руды), а также с галенитом, сфалеритом и урановой смолкой (в низкотемпературных гидротермальных месторождениях). Хотя молибденит считается устойчивым сульфидом по отношению к кислым и щелочным растворителям, в природных условиях при длительном воздействии воды и кислорода воздуха молибденит окисляется и молибден может интенсивно мигрировать с образованием вторичных минералов. Этим можно объяснить повышенные концентрации молибдена в осадочных отложениях - углистых и кремнисто-углистых сланцах и углях.
Известно около 20 минералов молибдена. Важнейшие из них: молибденит <https://ru.wikipedia.org/wiki/%D0%9C%D0%BE%D0%BB%D0%B8%D0%B1%D0%B4%D0%B5%D0%BD%D0%B8%D1%82> MoS2 (60 % Mo), повеллит <https://ru.wikipedia.org/w/index.php?title=%D0%9F%D0%BE%D0%B2%D0%B5%D0%BB%D0%BB%D0%B8%D1%82&action=edit&redlink=1> СаМоО4 (48 % Мо), молибдит <https://ru.wikipedia.org/w/index.php?title=%D0%9C%D0%BE%D0%BB%D0%B8%D0%B1%D0%B4%D0%B8%D1%82&action=edit&redlink=1> Fe(MoO4)3·nH2O (60 % Mo) ивульфенит <https://ru.wikipedia.org/wiki/%D0%92%D1%83%D0%BB%D1%8C%D1%84%D0%B5%D0%BD%D0%B8%D1%82> PbMoO4.
Получение.
Промышленное получение молибдена начинается с обогащения руд флотационным методом <https://ru.wikipedia.org/wiki/%D0%A4%D0%BB%D0%BE%D1%82%D0%B0%D1%86%D0%B8%D1%8F>. Полученный концентрат <https://ru.wikipedia.org/wiki/%D0%9C%D0%BE%D0%BB%D0%B8%D0%B1%D0%B4%D0%B5%D0%BD%D0%BE%D0%B2%D1%8B%D0%B9_%D0%BA%D0%BE%D0%BD%D1%86%D0%B5%D0%BD%D1%82%D1%80%D0%B0%D1%82> обжигают до образования оксида МоО3:
MoS2 + 7O2 → 2MoO3 +4SO2,
который подвергают дополнительной очистке. Далее МоО3 восстанавливают водородом:
MoO3 + 3H2 → Mo + 3H2O.
Полученные заготовки обрабатывают давлением (ковка <https://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D0%B2%D0%BA%D0%B0>, прокатка <https://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%BE%D0%BA%D0%B0%D1%82%D0%BA%D0%B0>, протяжка <https://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%BE%D1%82%D1%8F%D0%B6%D0%BA%D0%B0_(%D0%BF%D1%80%D0%BE%D1%86%D0%B5%D1%81%D1%81)>).
Физические свойства.
Молибден - светло-серый металл с кубической объёмноцентрированной решёткой (пространственная группа <https://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%BE%D1%81%D1%82%D1%80%D0%B0%D0%BD%D1%81%D1%82%D0%B2%D0%B5%D0%BD%D0%BD%D0%B0%D1%8F_%D0%B3%D1%80%D1%83%D0%BF%D0%BF%D0%B0> m3m), парамагнитен <https://ru.wikipedia.org/wiki/%D0%9F%D0%B0%D1%80%D0%B0%D0%BC%D0%B0%D0%B3%D0%BD%D0%B5%D1%82%D0%B8%D0%B7%D0%BC>, шкала Мооса <https://ru.wikipedia.org/wiki/%D0%A8%D0%BA%D0%B0%D0%BB%D0%B0_%D0%9C%D0%BE%D0%BE%D1%81%D0%B0> определяет его твердость 4.5 баллами. Механические свойства, как и у большинства металлов, определяются чистотой металла и предшествующей механической и термической обработкой (чем чище металл, тем он мягче). Обладает крайне низким коэффициентом теплового расширения <https://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D1%8D%D1%84%D1%84%D0%B8%D1%86%D0%B8%D0%B5%D0%BD%D1%82_%D1%82%D0%B5%D0%BF%D0%BB%D0%BE%D0%B2%D0%BE%D0%B3%D0%BE_%D1%80%D0%B0%D1%81%D1%88%D0%B8%D1%80%D0%B5%D0%BD%D0%B8%D1%8F>. Молибден является тугоплавким металлом c температурой плавления <https://ru.wikipedia.org/wiki/%D0%A2%D0%B5%D0%BC%D0%BF%D0%B5%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%B0_%D0%BF%D0%BB%D0%B0%D0%B2%D0%BB%D0%B5%D0%BD%D0%B8%D1%8F> 2620 °C и температурой кипения <https://ru.wikipedia.org/wiki/%D0%A2%D0%B5%D0%BC%D0%BF%D0%B5%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%B0_%D0%BA%D0%B8%D0%BF%D0%B5%D0%BD%D0%B8%D1%8F> - 4639 °C.
Химические свойства.
При комнатной температуре на воздухе молибден устойчив. Начинает окисляться при 400 °C. Выше 600 °C быстро окисляется до триоксида МоО3. Этот оксид получают также окислением дисульфида молибдена MoS2 <https://ru.wikipedia.org/wiki/%D0%94%D0%B8%D1%81%D1%83%D0%BB%D1%8C%D1%84%D0%B8%D0%B4_%D0%BC%D0%BE%D0%BB%D0%B8%D0%B1%D0%B4%D0%B5%D0%BD%D0%B0> и термолизом <https://ru.wikipedia.org/wiki/%D0%A2%D0%B5%D1%80%D0%BC%D0%BE%D0%BB%D0%B8%D0%B7> молибдата аммония (NH4)6Mo7O24·4H2O. Мо образует оксид молибдена (IV) МоО2 и ряд оксидов, промежуточных между МоО3 и МоО2. С галогенами <https://ru.wikipedia.org/wiki/%D0%93%D0%B0%D0%BB%D0%BE%D0%B3%D0%B5%D0%BD> Mo образует ряд соединений в разных степенях окисления. При взаимодействии порошка молибдена или МоО3 с F2 <https://ru.wikipedia.org/wiki/%D0%A4%D1%82%D0%BE%D1%80> получают гексафторид молибдена MoF6, бесцветную легкокипящую жидкость. Mo (+4 и +5) образует твердые галогениды MoHal4 и MoHal5 (Hal = <https://ru.wikipedia.org/wiki/%D0%A4%D1%82%D0%BE%D1%80>, Cl <https://ru.wikipedia.org/wiki/%D0%A5%D0%BB%D0%BE%D1%80>, Br <https://ru.wikipedia.org/wiki/%D0%91%D1%80%D0%BE%D0%BC>). С иодом известен только дийодид молибдена MoI2. Молибден образует оксигалогениды: MoOF4, MoOCl4, MoO2F2, MoO2Cl2, MoO2Br2, MoOBr3 и другие. При нагревании молибдена с серой образуется дисульфид молибдена <https://ru.wikipedia.org/wiki/%D0%94%D0%B8%D1%81%D1%83%D0%BB%D1%8C%D1%84%D0%B8%D0%B4_%D0%BC%D0%BE%D0%BB%D0%B8%D0%B1%D0%B4%D0%B5%D0%BD%D0%B0> MoS2, с селеном - диселенид молибдена состава MoSe2. Известны карбиды молибдена Mo2C и MoC - кристаллические высокоплавкие вещества и силицид молибдена MoSi2.
Особая группа соединений молибдена - молибденовые сини <https://ru.wikipedia.org/w/index.php?title=%D0%9C%D0%BE%D0%BB%D0%B8%D0%B1%D0%B4%D0%B5%D0%BD%D0%BE%D0%B2%D0%B0%D1%8F_%D1%81%D0%B8%D0%BD%D1%8C&action=edit&redlink=1>. При действии восстановителей - сернистого газа <https://ru.wikipedia.org/wiki/%D0%A1%D0%B5%D1%80%D0%BD%D0%B8%D1%81%D1%82%D1%8B%D0%B9_%D0%B3%D0%B0%D0%B7>, цинковой <https://ru.wikipedia.org/wiki/%D0%A6%D0%B8%D0%BD%D0%BA> пыли, алюминия <https://ru.wikipedia.org/wiki/%D0%90%D0%BB%D1%8E%D0%BC%D0%B8%D0%BD%D0%B8%D0%B9> или других на слабокислые (рН <https://ru.wikipedia.org/wiki/%D0%A0%D0%9D>=4) суспензии оксида молибдена образуются ярко-синие вещества переменного состава: Мо2О5·Н2О, Мо4О11·Н2О и Мо8О23·8Н2О. Mo образует молибдаты, соли не выделенных в свободном состоянии слабых молибденовых кислот, хН2О· уМоО3 (парамолибдат аммония 3(NH4)2O·7MoO3·zH2O; СаМоО4, Fe2(МоО4)3 - встречаются в природе). Молибдаты металлов I и III групп содержат тетраэдрические <https://ru.wikipedia.org/wiki/%D0%A2%D0%B5%D1%82%D1%80%D0%B0%D1%8D%D0%B4%D1%80> группировки [МоО4]. При подкислении водных растворов нормальных молибдатов образуются ионы MoO3OH−, затем ионы полимолибдатов: гепта-, (пара-) Мо7О266−, тетра-(мета-) Мо4О132−, окта- Мо8О264− и другие. Безводные полимолибдаты синтезируют спеканием МоО3 с оксидами <https://ru.wikipedia.org/wiki/%D0%9E%D0%BA%D1%81%D0%B8%D0%B4> металлов <https://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D1%82%D0%B0%D0%BB%D0%BB>. Существуют двойные молибдаты, в состав которых входят сразу два катиона, например, М+1М+3(МоО4)2, М+15М+3(МоО4)4. Оксидные соединения, содержащие молибден в низших степенях окисления - молибденовые бронзы, например, красная K0,26MoO3 и синяя К0,28МоО3. Эти соединения обладают металлической проводимостью и полупроводниковыми <https://ru.wikipedia.org/wiki/%D0%9F%D0%BE%D0%BB%D1%83%D0%BF%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BD%D0%B8%D0%BA> свойствами.
Применение.
Молибден используется для легирования <https://ru.wikipedia.org/wiki/%D0%9B%D0%B5%D0%B3%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5> сталей <https://ru.wikipedia.org/wiki/%D0%A1%D1%82%D0%B0%D0%BB%D1%8C>, как компонент жаропрочных и коррозионностойких <https://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D1%80%D1%80%D0%BE%D0%B7%D0%B8%D1%8F> сплавов <https://ru.wikipedia.org/wiki/%D0%A1%D0%BF%D0%BB%D0%B0%D0%B2>. Молибденовая проволока (лента) служит для изготовления высокотемпературных печей, вводов электрического тока в лампочках. Соединения молибдена - сульфид, оксиды, молибдаты - являются катализаторами химических реакций, пигментами красителей, компонентами глазурей. Гексафторид молибдена применяется при нанесении металлического Mo на различные материалы, MoS2 <https://ru.wikipedia.org/wiki/%D0%A1%D1%83%D0%BB%D1%8C%D1%84%D0%B8%D0%B4_%D0%BC%D0%BE%D0%BB%D0%B8%D0%B1%D0%B4%D0%B5%D0%BD%D0%B0(IV)>используется как твердая высокотемпературная смазка. Mo входит в состав микроудобрений. Радиоактивные изотопы 93Mo <https://ru.wikipedia.org/w/index.php?title=%D0%9C%D0%BE%D0%BB%D0%B8%D0%B1%D0%B4%D0%B5%D0%BD-93&action=edit&redlink=1> (T1/2 6,95ч) и 99Mo <https://ru.wikipedia.org/w/index.php?title=%D0%9C%D0%BE%D0%BB%D0%B8%D0%B1%D0%B4%D0%B5%D0%BD-99&action=edit&redlink=1> (T1/2 66ч) - изотопные индикаторы <https://ru.wikipedia.org/wiki/%D0%98%D0%B7%D0%BE%D1%82%D0%BE%D0%BF%D0%BD%D1%8B%D0%B5_%D0%B8%D0%BD%D0%B4%D0%B8%D0%BA%D0%B0%D1%82%D0%BE%D1%80%D1%8B>.
Молибден - один из немногих легирующих элементов <https://ru.wikipedia.org/wiki/%D0%9B%D0%B5%D0%B3%D0%B8%D1%80%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5>, способных одновременно повысить прочностные <https://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%BE%D1%87%D0%BD%D0%BE%D1%81%D1%82%D1%8C>, вязкие <https://ru.wikipedia.org/wiki/%D0%A3%D0%B4%D0%B0%D1%80%D0%BD%D0%B0%D1%8F_%D0%B2%D1%8F%D0%B7%D0%BA%D0%BE%D1%81%D1%82%D1%8C> свойства стали <https://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D1%85%D0%B0%D0%BD%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5_%D1%81%D0%B2%D0%BE%D0%B9%D1%81%D1%82%D0%B2%D0%B0_%D0%BC%D0%B0%D1%82%D0%B5%D1%80%D0%B8%D0%B0%D0%BB%D0%BE%D0%B2> и коррозионную стойкость. Обычно при легировании одновременно с увеличением прочности растет и хрупкость <https://ru.wikipedia.org/wiki/%D0%A5%D1%80%D1%83%D0%BF%D0%BA%D0%BE%D1%81%D1%82%D1%8C> металла. Известны случаи использования молибдена при изготовлении в Японии холодного оружия <https://ru.wikipedia.org/wiki/%D0%A5%D0%BE%D0%BB%D0%BE%D0%B4%D0%BD%D0%BE%D0%B5_%D0%BE%D1%80%D1%83%D0%B6%D0%B8%D0%B5> в XI <https://ru.wikipedia.org/wiki/XI_%D0%B2%D0%B5%D0%BA>-XIII <https://ru.wikipedia.org/wiki/XIII_%D0%B2%D0%B5%D0%BA> вв.
Молибден-99 <https://ru.wikipedia.org/w/index.php?title=%D0%9C%D0%BE%D0%BB%D0%B8%D0%B1%D0%B4%D0%B5%D0%BD-99&action=edit&redlink=1> используется для получения технеция-99 <https://ru.wikipedia.org/wiki/%D0%A2%D0%B5%D1%85%D0%BD%D0%B5%D1%86%D0%B8%D0%B9-99>, который используется в медицине при диагностике онкологических и некоторых других заболеваний. Чистый монокристаллический молибден используется для производства зеркал для мощных газодинамических лазеров. Теллурид молибдена <https://ru.wikipedia.org/w/index.php?title=%D0%A2%D0%B5%D0%BB%D0%BB%D1%83%D1%80%D0%B8%D0%B4_%D0%BC%D0%BE%D0%BB%D0%B8%D0%B1%D0%B4%D0%B5%D0%BD%D0%B0&action=edit&redlink=1> является очень хорошим термоэлектрическим материалом для производства термоэлектрогенераторов (термо-э.д.с 780 мкВ/К). Трёхокись молибдена (молибденовый ангидрид) широко применяется в качестве положительного электрода в литиевых источниках тока. Молибден применяется в высокотемпературных вакуумных печах сопротивления <https://ru.wikipedia.org/wiki/%D0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D0%BF%D0%B5%D1%87%D1%8C_%D1%81%D0%BE%D0%BF%D1%80%D0%BE%D1%82%D0%B8%D0%B2%D0%BB%D0%B5%D0%BD%D0%B8%D1%8F> в качестве нагревательных элементов и теплоизоляции. Дисилицид молибдена <https://ru.wikipedia.org/wiki/%D0%94%D0%B8%D1%81%D0%B8%D0%BB%D0%B8%D1%86%D0%B8%D0%B4_%D0%BC%D0%BE%D0%BB%D0%B8%D0%B1%D0%B4%D0%B5%D0%BD%D0%B0> применяется в качестве нагревателей в печах с окислительной атмосферой, работающих до 1800 °С[4].
Расчёт константы равновесия реакции MоO3+3С(графит) ↔ Mо+ 3СО в интервале температур 1300 - 2200K, двумя способами, с помощью энтропии и приведенной энергии Гиббса
Используя справочные данные по температурной зависимости изменения энтальпии реагентов, их энтропии, приведённой энергии Гиббса рассчитываем логарифм константы равновесия lnKp реакции MоO3+С(графит) ↔ Mо+3СО,в интервале температур 1300-2200K [1].
Расчёт производится двумя способами.
) С использованием абсолютных значений энтропии:
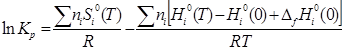 (5)
(5)
где ni - соответствующие стехиометрические коэффициенты, S°i(T) - стандартная абсолютная энтропия индивидуального вещества при данной температуре, H0i(T) - H0i(0) - высокотемпературные составляющие энтальпии индивидуального вещества, ∆fH0(0) - стандартная энтальпия образования индивидуального вещества при Т = 0 К [2].
Расчет при температуре 1300 К:
ΣniSio(1300) = S0Mo(1300) +3S0СO(1300) - 3S0Cгр(1300) - S0MoO3(1300)=
= 67.857+3*243.321-3*30.381-264.409=442.268Дж/моль*К
Σni*[Hi0(1300)-Hi0(0)+∆fHi0(0)]= 3[H0CO(1300)-H0CO(0)+∆fH0CO(0)]-
[H0Mo(1300)-H0Mo(0)+∆fH0Mo(0)]-3[H0Cгр(1300)-H0Cгр(0)+∆fH0Cгр(0)]-[H0MoO3 (1300)-H0MoO3(0)+∆fH0MoO3(0)]=3[40.535-113.812]+[31.922+0]-3[19.588+0
]-[163.684-739.587]=-219.831+31.922-58.764+575.903=329.23 кДж/моль
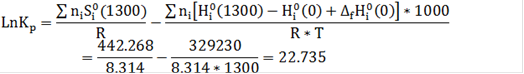
2) С помощью приведенной энергии Гиббса:
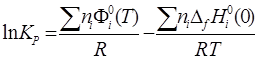 , где (6)
, где (6)
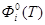 - приведенная энергия Гиббса;
- приведенная энергия Гиббса; 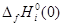 - стандартная теплота образования индивидуального вещества при Т=0 К.
- стандартная теплота образования индивидуального вещества при Т=0 К.
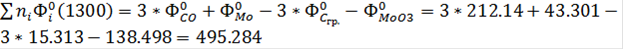
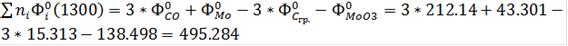
Дж/моль*К
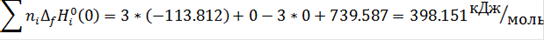
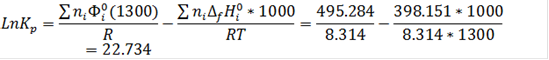
Аналогично рассчитывается константа равновесия химической реакции и для всех остальных температур из интервала 1300-2200K; все необходимые данные находятся в таблицах приложений. Полученные результаты для всего интервала температур приведены в таблице 3.
Таблица 3 - Расчет lnKp двумя способами в интервале температур 1300-2200K
| T,K | 1/T*103, К | Σni [Hi0(T)- Hi0(0)+∆f Hi0(0)],кДж/моль | I способ,lnKP | II способ,lnKP | КР |
| 0.769 | 329.23 | 22.735 | 22.734 | 7.5*10^9 | |
| 0.714 | 322.868 | 24.89 | 24.89 | 6.5*10^10 | |
| 0.667 | 311.568 | 26.722 | 26.722 | 6.0*10^11 | |
| 0.625 | 310.351 | 28.292 | 28.292 | 1,9*10^12 | |
| 0.588 | 304.229 | 29.652 | 29.655 | 7.6*10^12 | |
| 0.556 | 298.221 | 30.835 | 30.836 | 2.5*10^13 | |
| 0.526 | 292.333 | 31.875 | 31.874 | 6.96*10^13 | |
| 0.5 | 286.579 | 32.79 | 32.791 | 1.7*10^14 | |
| 0.476 | 280.954 | 33.603 | 33.604 | 3.9*10^14 | |
| 0.455 | 275.47 | 34.327 | 34.328 | 8.1*10^14 |
Используя полученный график (рисунок 4) и формулу:
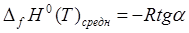 (7)
(7)
рассчитаем среднее значение теплового эффекта реакции:
ΔƒН0(Т)срдн= 

Вывод: Данная реакция является эндотермической, так как с ростом температуры увеличивается константа равновесия и равновесие смещается в сторону прямой реакции.
Вывод основан на принципе Ле - Шателье, который гласит: если на систему, находящуюся в равновесии, воздействовать извне и тем изменить условия, определяющие положение равновесия, то в системе усиливается то из направлений процесса, течение которого ослабляет влияние этого воздействия, в результате чего положение равновесия сместится в этом же направлении.
2. Построение и исследование диаграммы состояния двухкомпонентной системы Ge-Mo.
Построение и исследование диаграммы состояния Ge-Mo в атомных и массовых долях
Данная диаграмма, изображённая на рисунке 5, является двухкомпонентной системой с полной растворимостью в жидком состоянии, с ограниченной растворимостью в твердом состоянии, с образованием 4 неустойчивых химических соединений, c отсутствием полиморфизма.
Число степеней свободы находится по правилу фаз Гиббса:
С=К-Ф+1,
где С - степень свободы, которая характеризует число независимых параметров, которые можно свободно изменять; Ф - число фаз системы; К - число компонентов системы.
Фазовый состав:
I. L, однородный расплав, одна фаза, число термодинамических степеней свободы С=К-Ф+1=2-1+1=2, т.е. произвольно, не нарушая равновесия, можно изменять и температуру, и состав системы.
II. L + SМо, расплав находится в равновесии с твердым раствором на основе Мо, число термодинамических степеней свободы С=2-2+1=1, т.е. произвольно, не нарушая равновесия можно изменять или температуру, или состав системы.
III. L+ SМо3Ge, расплав находится в равновесии с неустойчивым химическим соединением Mo3Ge, число термодинамических степеней свободы С=2-2+1=1, т.е. произвольно, не нарушая равновесия можно изменять или температуру, или состав системы.
IV. SMo+ SМо3Ge, область существования в равновесии двух фаз: твердого раствора на основе Мо и неустойчивого химического соединения Mo3Ge.
V. SMo, область существования твердого раствора на основе Мо, одна фаза, число термодинамических степеней свободы С=2-1+1=2.
VI. L+SМо5Ge3, расплав находится в равновесии с твердым раствором на основе неустойчивого химического соединения Mo5Ge3, число термодинамических степеней свободы С=2-2+1=1.
VII. SМо5Ge3+SМо3Ge, область существования в равновесии неустойчивых химических соединений Mo3Ge и Mo5Ge3, число термодинамических степеней свободы С=2-2+1=1.
VIII. L+SМо13Ge23, расплав находится в равновесии с неустойчивым химическим соединением Mo13Ge23, число термодинамических степеней свободы С=2-2+1=1.
IX. SМо13Ge23+SМо5Ge3, область существования в равновесии неустойчивых химических соединений Mo13Ge23 и Mo5Ge3, число термодинамических степеней свободы С=2-2+1=1.
X. L+SGe, расплав находится в равновесии с Ge, число термодинамических степеней свободы С=2-2+1=1.
XI. L+S МоGe2, расплав находится в равновесии с неустойчивым химическим соединением MoGe2, число термодинамических степеней свободы С=2-2+1=1.
XII. SМоGe2+SМо13Ge23, область существования неустойчивых химических соединений MoGe2 и Mo13Ge23, число термодинамических степеней свободы С=2-2+1=1.
XIII. SGe+ SМоGe2, область существования в равновесии Ge и неустойчивого химического соединения MoGe2, число термодинамических степеней свободы С=2-2+1=1.
Переведём атомные доли в массовые, соответствующие следующим точкам: A=0,75 ат.д.; B=0,8 ат.д.; C=0,97ат.д. Для этого воспользуемся следующей формулой:
Масс.д.(Мо) = 

Проведём пересчёт для каждой из точек:
А:Масс.д.(Мо) = 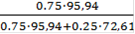
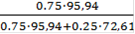 = 0.8
= 0.8
В:Масс.д.(Мо) = 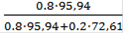
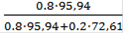 = 0.84
= 0.84
С:Масс.д(Мо) = 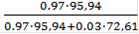
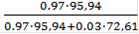 = 0.977
= 0.977
На данной диаграмме имеются 4 неустойчивых химических соединений:
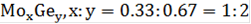
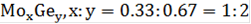 -
- 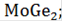
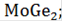
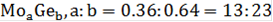
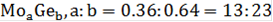 -
- 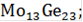
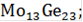

 -
- 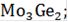
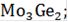

 -
- 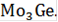
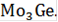
Температура начала кристаллизации расплава системы Ge-Mo, содержащей 0.2ат.д.Mo,равна 1490°С, температура конца кристаллизации равна 900°С.
Первые выпавшие кристаллы из расплава системы Mo-Ge, содержащего 0.2ат.д.Mo отвечают выпадению кристаллов химического соединения 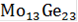
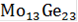 . Составу последней капли этого расплава соответствует точка эвтектики(E), содержащая 0.02ат.д.Mo.
. Составу последней капли этого расплава соответствует точка эвтектики(E), содержащая 0.02ат.д.Mo.
Воспользовавшись данными, полученными в пункте 2.1.1, определим по правилу рычага для системы Ge-Mo, содержащей 0.8ат.д.Mo при температуре 18500C и при массе сплава 70г.
mL/ mS=bc/ab;
mL+ mS= 70;= 70 - mS;
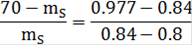
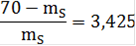
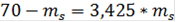
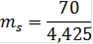
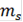
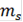 =15,82 г
=15,82 г
mL= 70 - 15,82 = 54,18 г
Число степеней свободы находится по правилу фаз Гиббса:
Отсюда следует, что система, у которой:
Состав 0.4ат.д.Mo, температура 1520 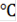
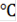 , имеет:К=2, Ф=3, С=2-3+1=0;
, имеет:К=2, Ф=3, С=2-3+1=0;
Состав 0.2ат.д. Mo, температура 1900 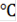
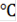 , имеет:К=2, Ф=1, С=2-1+1=2;
, имеет:К=2, Ф=1, С=2-1+1=2;
Состав 1.0ат.д. Mo, температура 2623 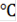
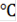 , имеет:K=1, Ф=2,C=1-2+1=0;
, имеет:K=1, Ф=2,C=1-2+1=0;
Система Ge-Mo содержащая 0,2 ат.д. Mo до температуры 1490 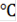
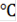 представляет собой однородный жидкий расплав Ф=1, С=2, при достижении температуры 1490
представляет собой однородный жидкий расплав Ф=1, С=2, при достижении температуры 1490 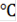
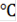 начинает кристаллизоваться химическое соединение
начинает кристаллизоваться химическое соединение 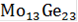
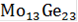 Ф=2, С=1. При охлаждении от 1490
Ф=2, С=1. При охлаждении от 1490 
 до 1090
до 1090 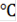
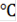 масса кристаллов
масса кристаллов 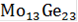
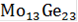 растёт, в составе расплава увеличивается содержание Ge. При достижении состава перитектики (P) начинается перитектическое превращение:
растёт, в составе расплава увеличивается содержание Ge. При достижении состава перитектики (P) начинается перитектическое превращение:
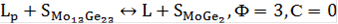
При охлаждении от 1090 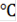
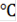 до 900
до 900 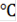
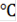 масса кристаллов химического соединения
масса кристаллов химического соединения 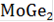
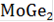 растёт, в составе расплава продолжает увеличиваться содержание Ge, при достижении состава точки E (0,02 Mo) начинается эвтектическое превращение:
растёт, в составе расплава продолжает увеличиваться содержание Ge, при достижении состава точки E (0,02 Mo) начинается эвтектическое превращение:
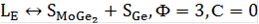
Которое заканчивается исчезновением расплава. При дальнейшем понижении температуры идёт охлаждение сплава содержащего две фазы Ge и 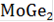
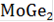 .
.
Список литературы.
1. Термодинамические свойства индивидуальных веществ. Т.1-4 книга вторая. Таблицы термодинамических свойств: Справочное издание / Под ред. В.П. Глушкова. - М.: Наука 1979.
2. Методические указания для выполнения курсовой работы по дисциплинам «Физическая химия» и «Химия». /ВГТУ; Сост. В.В. Корнеева, А.А Щетинин, А.Н. Корнеева, 2008. 24 с.
. Общая Химия. Глинка Н.Л. 1982
. https://ru.wikipedia.org (Молибден)
Приложение А
Значение термодинамических функций для Мо интервале температур 100-500K.
T.К 
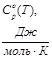
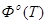
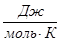 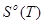 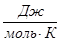 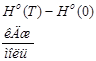
| ||||
| 13.520 | 2.087 | 6.997 | 0.491 | |
| 21.480 | 7.784 | 19.444 | 2.332 | |
| 23.970 | 13.304 | 28.718 | 4.624 | |
| 25.315 | 18.080 | 35.824 | 7.098 | |
| 26.005 | 22.221 | 41.554 | 9.666 |
Приложение Б
Значение термодинамических функций для Сграфит.
T,К 
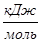
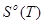
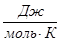
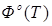
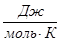
| |||
| 19.588 | 30.381 | 15.313 | |
| 21.96 | 32.138 | 16.453 | |
| 24.367 | 33.799 | 17.554 | |
| 26.802 | 35.371 | 18.619 | |
| 29.258 | 36.859 | 19.649 | |
| 31.729 | 38.272 | 20.645 | |
| 34.212 | 39.614 | 21.608 | |
| 36.703 | 40.892 | 22.54 | |
| 39.203 | 42.112 | 23.444 | |
| 41.71 | 43.278 | 24.319 |
ΔƒН0(0) = 0
Приложение В
Значение термодинамических функций для Mо.
T.К 
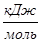
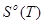
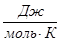
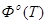
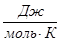
| |||
| 31.922 | 67.857 | 43.301 | |
| 34.951 | 70.101 | 45.136 | |
| 38.054 | 72.241 | 46.872 | |
| 41.237 | 74.295 | 48.522 | |
| 44.506 | 76.277 | 50.097 | |
| 47.868 | 78.199 | 51.605 | |
| 51.331 | 80.070 | 53.054 | |
| 54.900 | 81.901 | 54.451 | |
| 58.582 | 83.697 | 55.801 | |
| 62.384 | 85.466 | 57.109 |
ΔƒН0(0) = 0 кДж
Приложение Г
Значение термодинамических функций для СO
T.К 
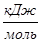
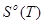
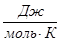
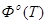
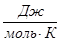
| |||
| 40.535 | 243.321 | 212.14 | |
| 44.01 | 245.896 | 214.469 | |
| 47.516 | 248.315 | 216.638 | |
| 51.051 | 250.596 | 218.689 | |
| 54.61 | 252.754 | 220.63 | |
| 58.191 | 254.8 | 222.472 | |
| 61.79 | 256.747 | 224.225 | |
| 65.407 | 258.601 | 225.898 | |
| 69.038 | 260.373 | 227.498 | |
| 72.683 | 262.068 | 229.031 |
ΔƒН0(0) = - 113.812 кДж
Приложение Д
Значение термодинамических функций для MоO3
T.К 
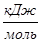
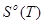
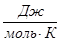
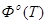
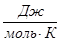
| |||
| 163.684 | 264.409 | 138.498 | |
| 176.384 | 273.82 | 147.832 | |
| 189.084 | 282.582 | 156.526 | |
| 201.784 | 290.779 | 164.664 | |
| 214.484 | 298.478 | 172.311 | |
| 227.184 | 305.737 | 179.524 | |
| 239.884 | 312.604 | 186.349 | |
| 252.584 | 319.118 | 192.826 | |
| 265.284 | 325.314 | 198.989 | |
| 277.984 | 331.222 | 204.866 |
ΔƒН0(0) = - 739.587 кДж