Алканы, общая формула, электронное и пространственное строение. Изомерия. Химические свойства алканов на примере метана.
Углеводороды - органические соединения, молекулы которых состоят из углерода и водорода.
К насыщенным (предельным) углеводородам принадлежат алканы.
Алканы - углеводороды, в молекулах которых атомы связаны одинарными связями.
СnH2n+2 Общая формула алканов.
Гомологический ряд алканов
| Состав алкана | Название |
| СН4 | метан |
| С2Н6 | этан |
| С3Н8 | пропан |
| С4Н10 | бутан |
| С5Н12 | пентан |
| С6Н14 | гексан |
| С7Н16 | гептан |
| С8Н18 | октан |
| С9Н20 | нонан |
| С10Н22 | декан |
| СnH2n+2 | алкан |
Если у молекулы алкана отнять 1 атом Н, то получится углеводородный радикал.
Радикалы - частицы с неспаренным электроном (алкил).
СН3 - метил
С2Н5 - этил
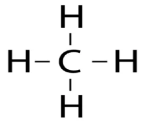
Электронное и пространственное строение молекулы метана.
СН4 - молекулярная формула
| - структурная формула |
Одинаковость связей С-Н в молекуле СН4 достигается за счет явления гибридизации (выравнивания) электронных облаков.


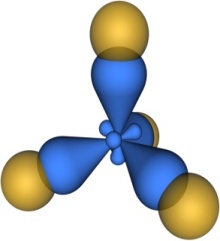
s 3p sp3 атом углерода молекула метана
Признаки алканов:
1) Тетраэдрическое строение
2) Валентный угол 109⁰ 28'
3) sp3-гибридизация
4) λ связи С-Н = 0,154 нм.
Изомерия.
Изомерия алканов обусловлена разветвленностью углеродного скелета.

Физические свойства алканов.
С1 - С4 - газы без цвета и без запаха.
С5 - С17 - бесцветные жидкости с характерным запахом бензина.
с С18 - твердые вещества белого цвета. жирные на ощупь.
Химические свойства.
При обычных условиях алканы химически инертны. При комнатной t они устойчивы к действию многих реагентов. Не взаимодействуют с:
1) Н2SO4 (конц)
2) НNО3 (конц)
3) конц. щелочами
4) КМnО4.
I. Реакции замещения – это реакции алканов, идущих с разрывом С – Н связей.
1) Галогенирование - взаимодействие с галогенами (за исключением фтора)
Атомы водорода в молекуле метана способны последовательно замещаться на атомы галогенов, например, хлора:
| хлорметан |


| дихлорметан |

| трихлорметан, хлороформ |

| тетрахлорметан |
Реакция галогенирования метана протекает по цепному радикальному механизму.
2) Нитрование по Коновалову (с раствором азотной кислоты при 140ºС).
| нитрометан |
| 140º С |
| + HО-NO2 СН3- NO2 + HOH |

II. Реакции окисления.
Горение.
При горении углеводородов всегда образуются СО2 и Н2О.
СН4 + 2О2 → СО2 + 2 Н2О + 880 кДж.
Каталитическое окисление.
При окислении СН4 кислородом воздуха в зависимости от Kat, t и р можно получить различные продукты:
| метиловый спирт |
| муравьиная кислота |
| формальдегид |

III. Реакции отщепления (элиминирования).
1) Дегидрирование - отщепление водорода (t, Kat)
CnH2n+2 → CnH2n + H2
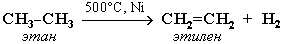
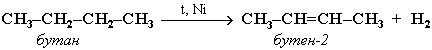
2) Крекинг (при 400 - 500 ºС) – разрушение цепи с образованием алкана и алкена.
C4H10 → C2H4 + C2H6
бутан этен этан
С6Н14 → СН3 - СН2 - СН3 + СН2 = СН - СН3
гексан пропан пропен
3) Пиролиз метана (нагрев до 1500 ºС)
| 1500 ⁰ С |
| Промежуточная стадия путем резкого охлаждения |
Получение алканов.
I. Промышленные способы.
1) Главным образом из природных источников - нефти и природного газа.
2) Гидрирование непредельных углеводородов.
| Kat, t, р |
СН2 = СН2 + Н2 СН3 - СН3
этилен этан

II. Лабораторные способы.
1) Реакция Вюрца
При нагревании моногалогенозамещенных алканов с металлическим Na или Zn-пылью получают алканы с удвоенным числом атомов.

