Схема экспериментальной установки для наблюдения ФДЭ на взвеси эритроцитов показана на рис.3.

Рис.3. Схема экспериментальной установки для наблюдения ФДЭ на взвеси эритроцитов: 1 — источник света, 2 — конденсор, 3, 6, 8 — диафрагмы; 4 — коллиматор; 5 — сменные интерференционные фильтры; 7 — кювета с исследуемой жидкостью; 9 — светоделительная пластинка; 10 — фотодиод; 11 — фотоэлемент; 12 — усилитель постоянного тока; 13 — измерительный прибор.
Экстинкция суспензии эритроцитов измеряется на фотоколориметре (приборе, измеряющем оптическую плотность на различных длинах волн). Используемый в лабораторной работе колориметр КФК-2 позволяет проделывать это на 9 длинах волн от 315 до 750 нм. Тем самым можно, хотя и грубо, но построить кривую спектра пропускания исследуемых жидких препаратов. Величина пропускания Т определяется отношением прошедшего через образец потока излучения I к падающему потоку I 0, приведенными к одному и тому же поперечному сечению:
 (2)
(2)
Для корректности определения Т оптическая схема колориметра содержит коллиматор и диафрагмы, обеспечивающие квазипараллельность проходящего через образец пучка излучения. Поскольку как спектральная интенсивность источника, так и спектральная чувствительность приемника зависят от длины волны, в приборе используется калибровочный канал, в который помещается кювета, заполненная растворителем (в данном случае, физраствором, оптическая плотность которого в рассматриваемом интервале длин волн мало отличается от водяной).
Измерение Т на каждой длине волны производится в 2 приема: сначала в луч вводится калибровочная кювета, и с помощью регулировки чувствительности приемного канала показания прибора устанавливаются на Т = 100%(шкала отградуирована в процентах). После этого прибор переключается на измерительный канал (калибровочная кювета выводится из луча и точно на ее место помещается измерительная кювета с испытуемой жидкостью). При правильной калибровке (100% пропускания при открытом окне фотоприемника и 0% при закрытом) показания прибора дают величину искомого пропускания. Против шкалы пропускания (равномерная от 0 до 100%) нанесена шкала оптических плотностей Д (логарифмическая) в соответствии с формулой
Д = - lg T (3)
Величина Д меняется в пределах от 0 (Т = 100%) до ¥ (Т = 0), однако фактическая возможность измерения Д определяется ценой деления шкалы. Так, при Т = 10% Д= 1; при Т = 1% Д = 2; производить измерения с точностью, превышающей 1% по Т, нереально, причем при малых пропусканиях (Т < 10%) ошибка резко возрастает. Поэтому реальным диапазоном измерения Д является 0 < Д < 2. По этой причине фактическая возможность абсолютного измерения концентрации исследуемого вещества по оптической плотности, в соответствии с формулой Ламберта-Бера
Д = с e L (4)
где с —концентрация поглощающего вещества, e — коэффициент молярной экстинкции, L —толщина образца (длина оптического пути излучения в испытуемой среде), затруднена. Однако относительная концентрация выживших частиц 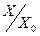 в зависимости от времени облучения t и дозы облучения D, имеющей смысл суммарной падающей на исследуемый пул клеток энергии излучения, может быть найдена на основе предложенной в МГУ им. М.В. Ломоносова и развитой в МГТУ им. Н.Э. Баумана математической модели (см. приложение).
в зависимости от времени облучения t и дозы облучения D, имеющей смысл суммарной падающей на исследуемый пул клеток энергии излучения, может быть найдена на основе предложенной в МГУ им. М.В. Ломоносова и развитой в МГТУ им. Н.Э. Баумана математической модели (см. приложение).
Простейший вариант этой модели основан на предположениях о пренебрежении репаративными процессами, преобладании химического механизма тушения, отсутствии кислородного голодания и определении доли выживших клеток сразу после прекращения облучения. Результатом расчета при таких предположениях будет следующая зависимость относительной концентрации от дозы:
 (5)
(5)
Здесь обозначено x t = D — доза воздействующего излучения,  — постоянная, характеризующая скорость гибели сенсибилизированных клеток в начальный момент облучения.
— постоянная, характеризующая скорость гибели сенсибилизированных клеток в начальный момент облучения.
 |
Найденная зависимость (5), будучи построенной в координатах (
 ), называется дозовой кривой. Коэффициент
), называется дозовой кривой. Коэффициент  характеризует крутизну этой кривой (см. приложение). В виде дозовой кривой можно представить и экспериментальные данные. Пример дозовой кривой приведён на рис. 4. Поскольку в дозовую кривую (5), определяющую зависимость ln
характеризует крутизну этой кривой (см. приложение). В виде дозовой кривой можно представить и экспериментальные данные. Пример дозовой кривой приведён на рис. 4. Поскольку в дозовую кривую (5), определяющую зависимость ln  от дозы облучения, входит не абсолютная концентрация сенсибилизированных частиц, а относительная, приводить в соответствие измеряемую оптическую плотность Д с абсолютной молярной концентрацией с нет необходимости, тем более, что коэффициент молярной экстинкции e априори неизвестен.
от дозы облучения, входит не абсолютная концентрация сенсибилизированных частиц, а относительная, приводить в соответствие измеряемую оптическую плотность Д с абсолютной молярной концентрацией с нет необходимости, тем более, что коэффициент молярной экстинкции e априори неизвестен.
Рис.4. Расчётные дозовые кривые в предположении о преобладании химического механизма тушения.
Правильное построение дозовых кривых для ФДЭ должно содержать:
а) выбор концентрации эритроцитов в суспензии в соответствии с исходным пропусканием образца в пределах Т = 20…30%, чтобы диапазон изменения пропускания при гемолизе эритроцитов был велик по сравнению с исходной величиной пропускания;
б) выбор концентрации ФС, достаточно большой для обеспечения полного поражения всех эритроцитов в образце, но при этом достаточно малой для того, чтобы исходное пропускание образца с добавленным ФС не сильно отличалось от несенсибилизированного (т.е. находилось в пределах тех же 20…30%);
в) обязательное измерение характеристик контрольного образца, выдерживаемого параллельно с облучаемым в темноте, с тем, чтобы выделять при каждом измерении ту оптическую плотность, которая определяется именно ФДЭ, а не всеми прочими причинами.
Основной серии измерений, позволяющих построить дозовую кривую, должны предшествовать 2 серии предварительных измерений:
а) спектральной характеристики пропускания суспензии эритроцитов (несенсибилизированной);
б) спектральной характеристики пропускания раствора ФС.
Эти кривые позволяют определить как предпочтительную длину волны источника засветки, так и длину волны, на которой следует вести измерения Т и Д для наиболее заметного проявления ФДЭ. Очевидно, что первая должна быть близка к максимуму поглощения ФС, вторая — к максимуму экстинкции суспензии эритроцитов. Доза облучения (в относительных единицах) определяется посредством измерения времени облучения.
В качестве контрольного, как в начале, так и по окончании опыта, следует провести измерение плотности потока излучения (освещенности), даваемой используемым источником. Это необходимо для того, чтобы можно было считать зависимость дозы D облучения от времени t линейной (обеспечение линейности, согласно формулам (П3) и (П8) приложения, имеет место только при I 0 = const).
Выполнение работы
Используемое оборудование и материалы:
1. Колориметр фотоэлектрический КФК-2.
2. Источники света: осветитель эндоскопический ОС-150 со световодным кабелем; светодиодная матрица с набором светодиодов, излучающих в красной области спектра; коллимированный источник света на базе лампы накаливания, используемый в микроскопии и для экспериментов на оптической скамье.
3. Люксметр (любой из выпускаемых промышленно, имеющий диапазон измерения освещенностей до 105 лк).
4. Микроскоп лабораторный с увеличением порядка 400…500 (безыммерсионный).
5. Штатив для установки образцов в процессе облучения или оптический столик из комплекта оптической скамьи.
6. Прямоугольные кюветы, пробирки, пипетки, протирочный материал (тонкая ткань, вата), спирт.
7. Физиологический раствор.
8. Фотосенсибилизаторы.
9. Ингибитор: гипосульфит (тиосульфат) натрия, в кристаллах.
10. Образцы крови (предлагаются преподавателем для исследования).
11. Дистиллированная вода.
Примечание: для исследования преподавателем может быть предложен новый тип ФС, ингибитора или другого соединения для наблюдения ФДЭ, а также различные образцы крови.
Порядок выполнения работы.
1. Изучить описание методики измерений, проанализировать схему эксперимента и порядок работы с измерительной аппаратурой (колориметр, люксметр, микроскоп, источник излучения).
2. Подготовить ответы на контрольные вопросы.
3. Приготовить растворы ФС в дистиллированной воде, снять необходимые характеристики пропускания растворов с помощью колориметра (Т = 60…70%). Поместить заготовленные растворы в темноту.
4. Приготовить суспензию эритроцитов нужной концентрации путем разбавления предложенного образца крови физраствором (Т = 20…30%). Предпочтительнее использовать кровь с введенными консервантами (гепарин и др.) для повышения стабильности ее оптических характеристик. Снять спектральную характеристику пропускания приготовленной суспензии и выделить оптимальную длину волны для наблюдения ожидаемого ФДЭ.
5. Приготовить с каждым из ФС не менее 3 проб (контрольная — темновая, 2 пробы ФС + эритроциты (одна проба облучается сразу, другая после инкубации), ФС + эритроциты + ингибитор или другой предложенный для изучения препарат). Зафиксировать время приготовления одной из проб ФС + эритроциты для дальнейшего подсчёта времени инкубации. Инкубация проводится для накопления ФС в клетке. Время инкубации ФС Фотогем и Радахлорин должно составлять не менее получаса, ФС Фотосенс — около часа. Поместить все образцы в темное место (лабораторный шкаф).
6. Измерить начальную плотность всех проб с помощью колориметра.
7. Произвести визуальный контроль всех проб с помощью микроскопа. Зарисовать результаты наблюдений с указанием характерных размеров эритроцитов и других наблюдаемых микрообъектов.
8. Измерить плотность потока выбранного источника излучения. Начать облучение одного из образцов ФС + эритроциты, выбрав время облучения перед первым измерением не более 0,5 минуты. Производить измерения оптической плотности и пропускания образцов после каждого облучения, постоянно держа необлучаемые в данный момент образцы в темноте. При каждом измерении производить визуальный контроль состояния эритроцитов через микроскоп. Каждое измерение должно быть выполнено не менее 5 раз для расчёта среднего значения и среднеквадратичной ошибки измерения. При появлении эффекта (изменении оптической плотности образца) измерения вести каждые 15 секунд. После окончания серии измерений (выхода на плато оптической плотности) произвести повторный контроль освещенности. Данные измерений занести в таблицу.
| Образец … (дать описание образца) | |||
| Время облучения, с | Пропускание, % | Полное время облучения, с | Полная доза облучения, Дж |
| Образец … (дать описание образца) | |||
| Время облучения, с | Пропускание, % | Полное время облучения, с | Полная доза облучения, Дж |
9. Сравнить полученные экспериментальные результаты с теоретической зависимостью, рассчитанной по формуле (5). Построить графики всех полученных экспериментальных кривых.
10. Выполнить пункты 4…8 с каждым из предложенных преподавателем ФС. Оценить по данным измерений дозу облучения, полученную каждым из облученных образцов.
11. Составить описание проделанных согласно п.3…10 действий и анализ полученных результатов.
12. Отчет по лабораторной работе должен включать в себя:
· Титульный лист с полным названием университета, факультета и кафедры, названием лабораторной работы, ФИО исполнителя и номера группы. Также должен быть указан год выполнения работы.
· Цель работы.
· Схему экспериментальной установки с описанием назначения каждого элемента схемы.
· Источник облучения, его мощность.
· Описание ФС, его разведения.
· Результаты исследований в виде таблиц и графиков.
· Описание расчёта дозы облучения.
· Результаты обработки экспериментальных данных с описанием метода обработки этих данных
· Численные и качественные выводы по результатам исследований. Качественные выводы вида «исследуемая функция в зависимости от изменяемого параметра увеличивается, уменьшается, не зависит, лучше, хуже» не допускаются.