Эти свойства зависят от природы растворителя и концентрации растворенного вещества и не зависят от свойств самого растворенного вещества. К ним относят:
1. Относительно понижение давление пара растворителя над раствором;
2. Повышение температуры кипения раствора по сравнению с чистым растворителем;
3. Понижение температуры замерзания раствора по сравнению с чистым растворителем;
4. Осмотическое давление.
Закон Рауля
По свойствам к идеальным растворам приближены предельно разбавленные растворы неэлектролитов. Изучая такие растворы, установлено, что относительное понижение давления насыщенного пара над раствором по сравнению с чистым растворителем прямо пропорционально мольной доле растворенного вещества.
р0–р – абсолютное понижение давление пара (Δр)
р0–р
р0 - относительное понижение давления пара
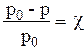
Следствие понижения давления пара растворителя над раствором является то, что растворы кипят при более высокой температуре и замерзают при более низкой температуре, чем чистый растворитель.
Следствия из закона Рауля
1. Повышение температуры кипения раствора по сравнению с чистым растворителем прямо пропорционально моляльной концентрации растворенного вещества:
ΔТкип = Е·Сm, где
ΔТкип = Ткип. раствора−Ткип. растворителя;
Е – эбулиоскопическая константа растворителя. Ее физический смысл: она численно равна ΔТкип раствора с Сm = 1 моль/кг.
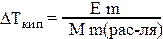
где m – масса растворенного вещества (г); М – молярная масса вещества (г/моль).
2. Понижение температуры замерзания раствора по сравнению с чистым растворителем прямо пропорционально моляльной концентрации растворенного вещества:
ΔТзам = К·Сm, где
ΔТзам = Тзам. раствора–Тзам. растворителя;
К – криоскопическая константа растворителя.
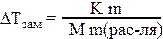
где m – масса растворенного вещества (г); М – молярная масса вещества (г/моль).
 3. Осмос – это односторонний процесс диффузии растворителя через полупроницаемую перегородку. Осмотическое давление (π) – это избыточное гидростатическое давление, которое необходимо приложить к раствору, чтобы осмос прекратился. Для разбавленных растворов неэлектролитов:
3. Осмос – это односторонний процесс диффузии растворителя через полупроницаемую перегородку. Осмотическое давление (π) – это избыточное гидростатическое давление, которое необходимо приложить к раствору, чтобы осмос прекратился. Для разбавленных растворов неэлектролитов:
π = СRT
C – концентрация раствора, моль/м3.
Если мы имеем дело с растворами электролитов, то необходимо учитывать коэффициент диссоциации вещества (i). Это коэффициент увеличения числа частиц или изотонический коэффициент. Растворы электролитов (и слабых, и, особенно, сильных) не подчиняются закону Рауля и его следствиям. Это связано с тем, что у них большая концентрация частиц (ионов и молекул), между которыми наблюдаются различные виды взаимодействий. Вант-Гофф предложил ввести в закон Рауля коэффициент i. Тогда он соблюдается для растворов электролитов. Коэффициент i > 1, имеет дробное значение, что означает, что не весь электролит распался на ионы. Тогда для растворов электролитов закон Рауля и его следствия записываются как:
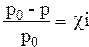 ΔТкип = i Е·Сm ΔТзам = i К·Сm π = i СRT
ΔТкип = i Е·Сm ΔТзам = i К·Сm π = i СRT
Коэффициент диссоциации связан со степенью диссоциации соотношением:
i = 1 + α(m + n – 1)
α для слабых электролитов – степень диссоциации;
α для сильных электролитов – кажущаяся степень диссоциации;
m − число катионов, на которое распался электролит;
n – число анионов, на которое распался электролит.
Также см. учебник А.А. Гуров, Ф.З. Бадаев, Л.П. Овчаренко, В.Н. Шаповал «Химия» М.: 2008, стр. 428 – 434.