ЛАБОРАТОРНАЯ РАБОТА №1.
ТЕМА: «СТРОЕНИЕ АТОМА. ХИМИЧЕСКАЯ СВЯЗЬ»
Теоретическая часть
Оптические спектры атома
Спектры, получаемые разложением испускаемого телами излучения, называются эмиссионными атомными спектрами. Спектры бывают непрерывными и линейчатыми.
Непрерывный спектр имеет излучение раскаленных твердых и жидких тел.
Линейчатый спектр дает излучение атомов в газообразном состоянии и включает ограниченное число спектральных линий (рис. 1).
Атом каждого элемента имеет свой спектр, который состоит из набора линий, отвечающих строго определенным значениям длин волн. Так, желтое окрашивание пламени газовой горелки при испарении в нем соли натрия обусловливается характеристической линией спектра натрия λ = 589,3 нм.
Возникновение линий в спектре обусловлено тем, что при возбуждении атомов (нагревание, электрический разряд и т.п.) электроны приобретают избыточную энергию и переходят в состояния с более высокими энергетическими уровнями (возбужден-ное состояние атома). В возбужденном состоянии электроны находятся короткое время (10-7 – 10-8 с). Далее они возвращаются в состояние с более низким энергетическим уровнем, при этом, согласно фундаментальному закону Δ Е = h υ, излучают кванты энергии, что отвечает появлению характерных спектральных линий.
Излучение сопровождается выделением кванта энергии Δ Е, величина которого равна разности энергий электронов в высшем и низшем энергетическом состояниях (Δ Е = Е в – Е н).
БЛОК-СХЕМА РАЗДЕЛА «СТРОЕНИЕ АТОМА»



|
|
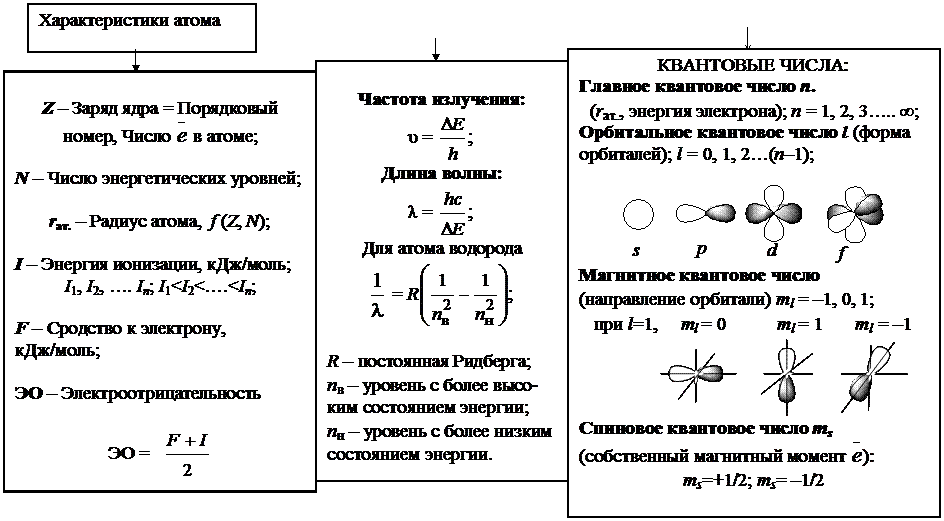 |

     |
Согласно уравнению М. Планка, Δ Е = h υ, где h – постоянная Планка (h = 6,62·10-34 Дж/с); υ – частота излучения. В свою очередь υ =  , где с = 3·108 мс-1. Следовательно, Δ Е =
, где с = 3·108 мс-1. Следовательно, Δ Е =  .
.
Энергия электрона резко убывает с возрастанием величины главного квантового числа и при n → ∞ стремится к нулю. Разности энергий электрона при переходе с одного уровня на другой также сильно убывают, квант излучаемой энергии уменьшается, длина волны растет и линии излучения переходят в инфракрасную область спектра (рис. 2).
Предельное возбуждение атома происходит при условии, когда из состояния невозбужденного атома электрон уходит в бесконечность, т.е. происходит ионизация атома.
Спектр атома водорода (получаемый действием разрядов в трубке) состоит из многочисленных линий, расположенных в ультрафиолетовых, видимых и инфракрасных областях спектра, так как газообразный водород содержит атомы разной степени возбуждения. На рис. 3 приведены энергии квантовых уровней атома водорода и возможные переходы электронов в возбужденном состоянии.
 |

0 200 400 600 нм
Рис. 3. Уровни энергии электрона в атоме водорода
Согласно теории атомных спектров Н. Бора, длины волн линий спектра атома водорода выражаются уравнением
 = R
= R  (1.1)
(1.1)
т.е. каждой длине волны λ соответствует величина Δ Е = Е в – Е н. Для других элементов длины волн характерных линий могут быть вычислены с достаточной точностью.
Для этого в выражение λ = hс /Δ Е подставим значения h и с и получим, что:
λ =  (нм).
(нм).
Для атомов щелочных и щелочноземельных металлов длина излучаемых электронами электромагнитных волн находится в преде-лах длин волн видимого света.
Химическая связь