ЕГЭ, химия Задание 4. Химическая связь
Химическая связь - это взаимодействие атомов, осуществляемое путем обмена электронами.
При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную – Н, Не) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа, т.е. завершить свой внешний уровень.
Образование химических связей между атомами – естественный, самопроизвольный процесс, так как при этом происходит понижение энергии молекулярной системы, т.е. энергия молекулярной системы меньше суммарной энергии изолированных атомов. Это движущая сила образования химической связи.
Природа химических связей – электростатическая, т.к. атомы есть совокупность заряженных частиц, между которыми действуют силы притяжения и отталкивания, которые приходят в равновесие.
В образовании связей участвуют неспаренные электроны, находящиеся на внешних атомных орбиталях (или готовые электронные пары) – валентные электроны. Говорят, что при образовании связей происходит перекрывание электронных облаков, в результате чего между ядрами атомов возникает область, где вероятность нахождения электронов обоих атомов максимальна.
Чтобы определить тип химической связи в соединении задайте 2 вопроса.
1. Это простое или сложное вещество?
2. Между какими типами атомов (металлические или неметаллические) образуется связь?
Варианты ответов и тип химической связи указаны в таблице.
  Вещество Вещество
| |||
  простое простое
|   сложное сложное
| ||
| атомы металла | атомы неметалла | неметалл+неметалл | металл+неметалл |
| Металлическая связь | Ковалентная неполярная связь | Ковалентная полярная связь | Ионная связь |
| Cu, Au, Fe, Na | H2, N2, O2, Cl2, Br2 | HCl, NH3, H2S, H2O,CH4 | Na2O, Al2O3, BaCl2 |
Классификация химических связей
1. По механизму образования химической связи.
а) обменный, когда оба атома, образующие связь, предоставляют для неё неспаренные электроны.
Например, образование молекул водорода Н2 и хлора Cl2:
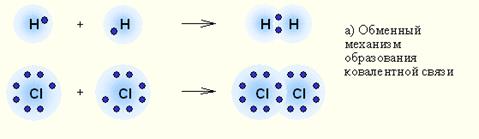
б) донорно – акцепторный, когда один из атомов предоставляет для образования связи готовую пару электронов (донор), а второй атом – пустую свободную орбиталь.
Например, образование иона аммония (NH4)+ (заряженная частица):
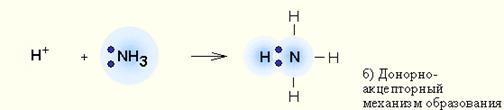
По способу достижения завершенной электронной оболочки.
Каждый атом стремится завершить свою внешнюю электронную оболочку, при этом способов достижения такого состояния может быть несколько.
Ковалентная связь - это связь, возникающая между атомами за счет образования общих электронных пар (Например, H2, HCl, H2O, O2).
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
А) Ковалентная неполярная связь (КНС) - образуют атомы одного и того же химического элемента - неметалла (Например, H2, O2, О3).
Механизм образования связи.
Каждый атом неметалла отдает в общее пользование другому атому наружные не спаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Б) Ковалентная полярная связь (КПС) - образуют атомы разных неметаллов, отличающихся по значениям электроотрицательности (Например, HCl, H2O).
Механизм образования связи.
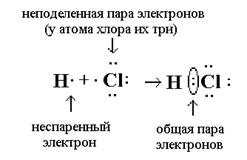 Каждый атом неметалла отдает в общее пользование другому атому свои наружные неспаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу.
Каждый атом неметалла отдает в общее пользование другому атому свои наружные неспаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу.
Ионная связь (ИС) – образуется между атомами металлов и неметаллов, т.е. между атомами, резко отличающимися друг от друга по значениям электроотрицательности. (Например, NaCl, K2O, LiF)
Механизм образования связи.
Атом неметалла забирает наружные электроны у атома металла и превращается в анион (отрицательно заряженный ион). Атом металла теряет электроны и превращается в катион (положительно заряженный ион). Ионы связаны электростатическими силами. Происходит полная отдача (принятие) валентных электронов, перекрывание облаков отсутствует, обобществления электронов не наблюдается.
Рассмотрим механизм образования молекулы фторида натрия:
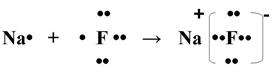
В результате образования связи электронная пара полностью сместилась к атому фтора, разноименно заряженные иона натрия и фтора притягиваются за счёт электростатического взаимодействия.
Металлическая связь - связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке.
У атомов всех металлов на внешнем электронном слое присутствуют электроны, имеющие низкую энергию связи с ядром атома. Для большинства металлов, энергетически выгодным является процесс потери внешних электронов.
Ввиду такого слабого взаимодействия с ядром эти электроны в металлах весьма подвижны и в каждом кристалле металла непрерывно происходит следующий процесс:
М0 — ne− = Mn+,
где М0 – нейтральный атом металла, а Mn+ катион этого же металла. На рисунке ниже представлена иллюстрация происходящих процессов.
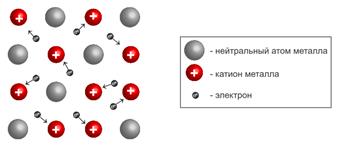
То есть по кристаллу металла «носятся» электроны, отсоединяясь от одного атома металла, образуя из него катион, присоединяясь к другому катиону, образуя нейтральный атом. Такое явление получило название “электронный ветер”, а совокупность свободных электронов в кристалле атома неметалла назвали “электронный газ”. Подобный тип взаимодействия между атомами металлов назвали металлической связью.
Водородная связь
Если атом водорода в каком-либо веществе связан с элементом с высокой электроотрицательностью (азотом, кислородом или фтором), для такого вещества характерно такое явление, как водородная связь.
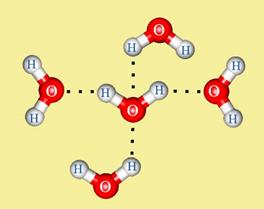 Поскольку атом водорода связан с электроотрицательным атомом, на атоме водорода образуется частичный положительный заряд, а на атоме электроотрицательного элемента — частичный отрицательный. В связи с этим становится возможным электростатическое притяжения между частично положительно заряженным атомом водорода одной молекулы и электроотрицательным атомом другой. Например, водородная связь наблюдается для молекул воды. Именно водородной связью объясняется аномально высокая температура ее плавления.
Поскольку атом водорода связан с электроотрицательным атомом, на атоме водорода образуется частичный положительный заряд, а на атоме электроотрицательного элемента — частичный отрицательный. В связи с этим становится возможным электростатическое притяжения между частично положительно заряженным атомом водорода одной молекулы и электроотрицательным атомом другой. Например, водородная связь наблюдается для молекул воды. Именно водородной связью объясняется аномально высокая температура ее плавления.
Итак, водородные связи возникают между следующими веществами:
- вода H2O (пар, лед, жидкая вода):
- фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота),
- раствор аммиака и органических аминов — между молекулами аммиака и воды;
- органические соединения, в которых есть связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.