Здравствуйте второй курс. Изучите презентацию и материал по теме «Алкины». Составьте конспект. Решите тест в конце задания. Это задание вам на один час пятницы и на субботу.
Физические и химические свойства алкинов
ОПРЕДЕЛЕНИЕ
Алкины – непредельные углеводороды, молекулы которых содержат одну тройную связь, в названии алкинов присутствует суффикс –ин.
Общая формула алкинов CnH2n-2
Электронное строение молекулы ацетилена
Структурная формула ацетилена имеет вид HC ≡ CH. Два атома углерода, связанные тройной связью, находятся в состоянии sp-гибридизации. Каждый такой атом имеет две sp-гибридные орбитали, расположенные под углом 180o. За счет осевого перекрывания одной из этих орбиталей атом углерода образует σ-связь с другим атомом углерода, а за счет второй sp-гибридной орбитали — σ-связь с атомом водорода. σ-Скелет молекулы имеет линейное строение (рис. 1).
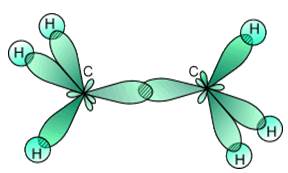
Рис. 1. Строение молекулы ацетилена.
Оставшиеся негибридизованными две p-орбиталикаждого атома углерода расположены под углом 90o одна к другой. При боковом перекрывании этих орбиталей с соответствующими p-орбиталями другого sp-гибридизованного атома углерода образуются две π-связи, расположенные в двух взаимно перпендикулярных плоскостях.
Таким образом, тройная связь образуется из трех пар обобществленных электронов, т.е. это шестиэлектронная связь. Она представляет собой сочетание одной σ- и двух π-связей. π-Электронное облако тройной связи имеет вид цилиндра, охватывающего оба атома углерода.
Алкины — ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле СпН2n-2.
Атомы углерода, между которыми образована тройная связь, находятся в состоянии sр — гибридизации. Это означает, что в гибридизации участвуют одна s- и одна р-орбиталь, а две р-орбитали остаются негибридизованными. Перекрывание гибридных орбиталей приводит к образованию σ — связи, а за счет негибридизованных р-орбиталей соседних атомов углерода образуются две π — связи. Таким образом, тройная связь состоит из одной σ -связи и двух π -связей.
Все гибридные орбитали атомов, между которыми образована двойная связь, а также заместители при них (в случае этина — атомы водорода) лежат на одной прямой, а плоскости л-связей перпендикулярны друг другу.
Тройная углерод-углеродная связь с длиной 0,12 нм короче двойной, энергия тройной связи больше, т. е. она является более прочной.
Изомерия и номенклатура алкинов
Для алкинов характерна структурная изомерия: изомерия углеродного скелета и изомерия положения кратной связи. Простейший алкин, для которого характерны структурные изомеры положения кратной связи класса алкинов, — это бутин:
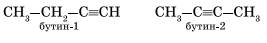
Изомерия углеродного скелета у алкинов возможна, начиная с пентина:
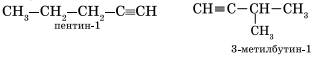
Так как тройная связь предполагает линейное строение углеродной цепи, геометрическая (цис-, транс-) изомерия для алкинов невозможна.
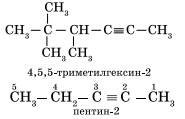
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом — ин, а ее положение в цепи — номером атома углерода. Например:
Алкинам изомерны соединения некоторых других классов. Так, химическую формулу С6Н10 имеют гексин (алкин), гексадиен (алкадиен) и циклогексен (циклоалкен):
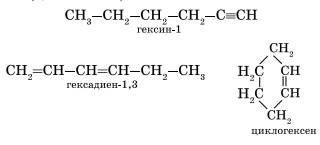
Таблица 1. Гомологический ряд алкинов.
| Название химического соединения | Структурная формула |
| Этин (ацетилен) | C2H2 (СH≡CH) |
| Пропин (метилацетилен) | C3H4 (СH≡C-CH3) |
| Бутин | C4H6 |
| Пентин | C5H8 |
| Гексин | C6H10 |
| Гептин | C7H12 |
| Октин | C8H14 |
| Нонин | C9H16 |
| Декин | C10H18 |
Чтобы дать название алкину необходимо выбрать самую длинную углеводородную цепь, содержащую тройную связь. Нумерация цепи начинается с того края, ближе к которому находится тройная связь.
Атомы углерода тройной связи в молекулах алкинов находятся в sp-гибридизации: две σ-связи располагаются на одной линии под углом 180  С друг к другу, две π-связи образованы p-электронами соседних атомов углерода и располагаются во взаимно перпендикулярных плоскостях. Тройная связь является сочетанием одной σ- и двух π-связей.
С друг к другу, две π-связи образованы p-электронами соседних атомов углерода и располагаются во взаимно перпендикулярных плоскостях. Тройная связь является сочетанием одной σ- и двух π-связей.
Для алкинов, начиная с пентина, характерна изомерия углеродного скелета:
CH≡C-CH2-CH2-CH3 (пентин-1)
CH≡C-CH(CH3)-CH3 (3-метилбутин1)
начиная с бутина, для всех алкинов характерна изомерия положения тройной связи:
CH≡C-CH2-CH3 (бутин-1)
CH3-C≡C-CH3 (бутин-2)
Для алкинов характерна межклассовая изомерия с алкадиенами, так веществу с составом C4H6, соответствует три разных вещества – бутин-1, бутин-2 и бутадиен-1,3.
Химические свойства алкинов
Для алкинов характерны реакции присоединения, протекающие по нуклеофильному механизму, такие как:
— гидрирование – присоединение воды в присутствии 18%-й серной кислоты, сульфата ртути (II) и нагревании до 90  С (реакция Кучерова), в результате чего образуются альдегиды
С (реакция Кучерова), в результате чего образуются альдегиды
СH≡CH +H2O → [CH2 = CH-OH] → CH3-CH = O
— галогенирование – присоединение галогенов, протекающее в две стадии
СH≡CH +Br2 →CHBr = CHBr + Br2 →CHBr2-CHBr2
— гидрогалогенирование – присоединение галогеноводородов, также, протекающее в две стадии и присоединение второй молекулы галогеноводорода протекает по правилу Марковникова (присоединение галогеноводородов к тройной связи протекает труднее, чем к двойной)
СH≡CH +HСl → CH2 = CHCl + HCl → CH3-CHCl2
Для алкинов, имеющий концевую тройную связь, характерно наличие слабых кислотных свойств. Такие алкины способны образовывать соли при взаимодействии с активными металлами:
2R-C≡C-H +2Na →2R-C≡C-Na + H2
Ацетилинид серебра легко образуется и выпадает в осадок при пропускании ацетилена через аммиачный раствор оксида серебра:
СH≡CH + Ag2O → Ag- С≡C-Ag↓ + H2O
Ацетилен способен тримеризоваться – при пропускании ацетилена над активированным углем при 600  С образуется бензол:
С образуется бензол:
3C2H2 → C6H6
Для алкинов характерны реакции окисления и восстановления. Так, алкины легко окисляются перманганатом калия. В результате этой реакции образуются карбоновые кислоты:
R- С≡C-R’ +[O] +H2O → R-COOH + R’-COOH
В присутствии металлических катализаторов алкины присоединяют молекулы водорода:
CH3-C≡CH + H2 → CH3-CH = CH2 + H2 → CH3-CH2-CH3
Качественными реакциями на тройную связь являются реакции обесцвечивания раствора бромной воды и перманганата калия, а также реакция с аммиачным раствором оксида серебра в случае концевого положения тройной связи.
Физические свойства алкинов
При обычных условиях C2-С4 – газы, С5-С16 – жидкости, начиная с С18 – твердые вещества. Температуры алкинов выше, чем у соответствующих алкенов.
Получение алкинов
Для получения алкинов чаще всего используют:
— реакции дегидрирования алканов и алкенов
CH3-CH3 → СH≡CH +2H2;
CH2 = CH2 → СH≡CH +H2.
— реакции элиминирования дигалогенпроизводных
(CH3)3-CCl2-CH3 +2KOH →(CH3)3-C≡CH + 2KCl + 2H2O.
— реакции ацетиленидов с первичными галогеналканами
СH≡CNa + CH3-CH2-CH2-Br →СH≡C-(CH2)3-CH3 + NaBr.
Применение алкинов.
Из алкинов особое значение имеет ацетилен.
Ацетилен из-за достигаемой высокой температуры пламени широко используется для резки и сварки металлов в ацетилен-кислородной сварке (расходуется до 30 % всего производимого ацетилена).
При его горении в кислороде пламя его достигает температуры 28000С.
Простота получения, относительно низкая стоимость, имическая активность сделали ацетилен важнейшим сырьем для многочисленных промышленных синтезов:
1. Хлорированием ацетилена получают дихлорэтилен и трихлорэтилен, применяемые в качестве растворителей. А также получают тетрахлорэтан, который применяется как растворитель (жиров, смол, каучука и др.), для получения фреонов, как экстрагент, в медицине.
2. Димеризацией ацетилена с последующим гидрохлорированием получают хлоропрен – мономер для хлоропренового каучука.
3. Гидрохлорированием ацетилена получают винилхлорид – мономер для получения поливинилхлорида (основа линолеума, разнообразной упаковки, труб и др.).
4. Гидратацией ацетилена получают уксусный альдегид, идущий на получение уксусной кислоты.
5. Присоединением циановодорода к ацетилену получают акрилонитрил – мономер для получения синтетического волокна «нитрон».
6. Присоединением к ацетилену уксусной кислоты получают винилацетат – мономер для получения поливинилацетата (ПВА).
Поливиилацетат – основа для клеев, водоэмульсионных и акриловых красок, используется в производстве лаков.
Тестовый контроль знаний: Алкины
Часть А
А1. Бутин-1 и бутин-2 являются:
1) структурными изомерами; 2) геометрическими изомерами;
3) гомологами; 4) одним и тем же веществом.
А2.Число изомеров для вещества состава С4Н6:
1) 4 2) 3 3) 5 4) 6
А3. Объем порции бутина (в литрах, н.у.), в которой содержится 1,505 х 1023 атомов углерода, равен…
1) 5,6 2) 14 3) 56 4) 220
А4. При взаимодействии пропина с водой по реакции Кучерова образуется:
1) ацетальдегид 2) ацетон 3) пропан 4) пропандиол-1,2
А5. Способ получения ацетилена в промышленности – это:
1) гидрирование бензола 2) дегидратация и дегидрирование этанола
3) гидратация этилена 4) крекинг метана
А6. С ацетиленом не взаимодействует:
1) оксид углерода (IV) 2) хлороводород 3) бромная вода 4) кислород
А7. Органическое вещество, в котором орбитали всех атомов углерода находятся в состоянии sp-гибридизации:
1) пропин 2) бутадиен-1,3 3) этен 4) этин
А8. С помощью аммиачного раствора оксида серебра можно отличить…
1) пропен от бутена-1 2) пропан от бутана 3) этин от этена 4) пропен от пропана
А9. В схеме 2,2-дихлорбутан+2KOH(сп.) = А + 2KCl + 2HOH
вещество А относят к:
1) алканам; 2) алкенам; 3) алкинам; 4) алкадиенам.
Часть В
В1. Число сигма - связей в молекуле бутина-1.
В2. Для полной реакции с ацетиленом объемом 1,12 л (н.у.) необходимо взять бромную воду с массовой долей 1,6% и массой … (в граммах).
В3. Число сигма - связей в молекуле пропина…
В4. Алкин массой 6,8 г присоединяет 640 г 5%-ного раствора брома. Укажите молярную массу алкина.
В5. Число атомов углерода в молекуле алкина с относительной молекулярной массой 68.
Примеры решения задач
| Задание1. | 1 г алкина при н.у. занимает объем 0,56 л. Выведите молекулярную формулу алкина. |
| Решение | Количество вещества алкина можно найти, используя следующие формулы: v = m/M v = V/Vm Следовательно, можно записать, что m/M = V/Vm Тогда, молекулярная масса алкина будет равна: M = m×Vm/V Запишем формулу алкана в общем виде CnH2n-2 И выразим молекулярную массу алкина: M = 12n+2n-2 = 14n-2 Приравняем выражения, записанные для нахождения молекулярной массы алкина: 14n-2 = m×Vm/V 14n-2 = 1×22,4/0,56 14n-2 = 40 14n = 42 n = 3 Запишем формулу алкина C3H8 |
| Ответ | Формула алкинаC3H8 – это пропин |
| Задание2. | При пропускании смеси пропана и ацетилена через склянку с бромной водой масса склянки увеличилась на 1,3 г. При полном сгорании такого же количества исходной смеси углеводородов выделилось 14 л (н.у.) оксида углерода (IV). Определите массовую долю пропана в исходной смеси. |
| Решение | Ацетилен поглощается бромной водой: НC ≡ СH + 2Вr2→ НСВr2 -СНВr2 1,3 г — это масса ацетилена, следовательно, количество вещества ацетилена: v(C2H2) = 1,3/26 = 0,05 моль При сгорании этого количества ацетилена по уравнению 2С2Н2 + 5О2 = 4СО2 + 2Н2О Выделилось: 2-0,05 = 0,1 моль СО2 Общее количество СО2 равно: 14/22,4 = 0,625 моль При сгорании пропана по уравнению С3Н8 + 5О2 = ЗСO2 + 4Н2О Выделилось 0,625 — 0,1 = 0,525 моль СО2 при этом в реакцию вступило 0,525/3 = 0,175 моль С3Н8 Масса пропана: 0,175 — 44 = 7,7 г. Общая масса смеси углеводородов равна: 1,3+7,7 = 9,0 г Массовая доля пропана составляет: w(С3Н8) = 7,7/9,0 = 0,856, или 85,6%. |
| Ответ | Массовая доля пропана 85,6%. |