ХИМИЯ
Лечебное дело, педиатрия
ТЕМА 2. ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ. КАТАЛИЗ
Программа
2.1. Предмет и основные понятия химической кинетики. Химическая кинетика как основа для изучения скоростей и механизмов биохимических процессов. Скорость реакции, средняя скорость реакции в интервале, истинная скорость. Классификации реакций, применяющиеся в кинетике: реакции, гомогенные, гетерогенные и микрогетерогенные; реакции простые и сложные (параллельные, последовательные, сопряженные, цепные). Молекулярность элементарного акта реакции.
2.2. Кинетические уравнения. Порядок реакции. Период полупревращения. Зависимость скорости реакции от концентрации. Кинетические уравнения реакций первого, второго и кулевого порядков. Экспериментальные методы определения скорости и константы скорости реакций.
2.3. Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции и его особенности для биохимических процессов. Понятие о теории активных соударении. Энергетический профиль реакции; энергия активации; уравнение Аррениуса. Роль стерического фактора. Понятие о теории переходного состояния.
2.4. Катализ. Гомогенный и гетерогенный катализ. Энергетический профиль каталитической реакции. Особенности каталитической активности ферментов. Уравнение Михаэлиса - Ментен и его анализ.
Основная литература
1. Юшкова Е.И., Саушкина Е.А. Теоретические основы химии: учебно-методическое пособие. Орел: ОГУ имени И.С. Тургенева, 2017. С. 33 - 45.
2. Ершов Ю.А., Попков В.А., Берлянд А.С., Книжник А.3. Общая химия. Биофизическая химия. Химия биогенных элементов: Учебник для студентов медицинских специальностей высших учебных заведений. М.: Высшая школа, 2010.
3. Общая химия. Под ред. В.А. Попкова. - М.: ГЭОТАР-Медиа, 2014 - 400 с.
В.И. Слесарев «Химия», «Основы химии живого» -СПб Химиздат, 2000г.
4. Тестовые задания по химии. Учебно-методическое пособие для самостоятельной работы студентов специальностей Лечебное дело, Педиатрия, Стоматология. /сост. Е.И. Юшкова, Е.А. Саушкина. - Орел, Орловский государственный университет, 2017. - 39 с.
Дополнительная литература
1. Третьяков Ю.Д., Л.И. Мартыненко, А.Н. Григорьев, А.Ю. Цивадзе. Неорганическая химия. Химия элементов: Учебник для вузов. В 2 книгах. М., Химия, 2010.
2. Лидин Р.А., Молочко В.А., Андреева Л.Л. Неорганическая химия в реакциях. Справочник. 2-е изд., перераб. и доп. - М.: Дрофа, 2007 - 637 с.
3. Саушкина Е.А., Друшляк Н.Г. Окислительно-восстановительные реакции. Учебно-методическое пособие по курсу общей и неорганической химии. Орел, полиграфическая фирма «Картуш», 2014. – 56 с.
4. Юшкова Е.И., Саушкина Е.А., Королева И.П. Методическое руководство к практикуму по общей химии. – Орел: Изд-во ОРАГС, 2006. 2-е издание – 180 с.
5. Саушкина Е.А., Юшкова Е.И., Королева И.П. Химические элементы. Часть 1. s-элементы. Орел, 2008. – 113 с.
ЗАДАНИЕ № 2 ПО ТЕМЕ
«ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ. КАТАЛИЗ»
I. Вопросы для самоподготовки: п. 2.1.-2.4 программы.
II. К занятию решить задачи:
1. Скорость некоторой реакции при охлаждении от 80 до 600C уменьшилась в 4 раза. Найдите температурный коэффициент скорости реакции. (γ = 2)
2. Константа скорости гидролиза сахарозы при 25°С равна 3,2 · 10-3 ч-1. Рассчитайте: а) время за которое подвергнется гидролизу 10% исходного количества сахарозы; б) какая часть сахарозы подвергнется гидролизу через 5 суток; в) период полупревращения реакции .(68%, τ0,5= 26 ч)
3. Константа скорости простой реакции NO + О3 → NO2+ О2 равна 0,1 л/(моль·мин).
а) рассчитайте скорость реакции при Со(NO) = 0,4 моль/л и Со(О3) = 0,3 моль/л.
б) рассчитайте скорость реакции в момент, когда концентрация озона уменьшится в три раза. (V1 = 0,012 моль/л·мин, V2=0,004 моль/л·мин)
4. В некоторый момент времени концентрация хлора в сосуде, в котором протекает реакция H2+Cl2=2HCl, была равна 0,06 моль/л. Через 5 сек концентрация хлора составила 0,02 моль/л. Чему равна средняя скорость данной реакции в указанный промежуток времени? (V = 0,008 моль/л · с.)
III. Лабораторная работа «Исследование зависимости скорости реакции разложения тиосерной кислоты от концентрации реагирующих веществ».
Оформите дома лабораторную работу в соответствии с предложенным ниже образцом.
Приложение.
Примеры решения задач.
Задача № 1. Найти константу равновесия реакции N2O4 Ы2NO2, если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту достижения равновесия диссоциации подверглось 60% N2O4.
Дано: N2O4 ↔ 2NO2 
Сисх.(N2O4) = 0,08 моль/л согласно ЗДМ для равновесия:
ωp = 60% = 0,6 [NO2]2
Kp = 

Kp =? [N2O4]
Для нахождения константы равновесия следует знать равновесные концентрации веществ NO2 и N2O4.
C (N2O4)прореаг. = Сисх.(N2O4) ∙ ωp = 0,08 ∙ 0,6 = 0,048 моль/л
[N2O4] = 0.08 – 0,048 = 0,032 моль/л.
[NO2] = C (NO2)образ. = 2 ∙ C (N2O4)прореаг. = 2 ∙ 0,048 = 0,096 моль/л.
[NO2]2 (0,096)2
Kp = = = 0,288 моль/л. 

[N2O4] 0,032
Ответ: Kp = 0,288 моль/л.
Задача № 2. Найти константу равновесия реакции N2O4 ↔ 2NO2, если равновесные концентрация N2O4 и NO2 составляли 0,04 моль/л и 0,05 моль/л, соответственно. Вычислите исходную концентрацию оксида азота (IV).
Дано: N2O4 ↔ 2NO2 
[N2O4] = 0,04 моль/л согласно ЗДМ для равновесия:
[NO2] = 0,05 моль/л [NO2]2 0,052
Kp = = = 0,0625 моль/л. 


Kp =? [N2O4] 0,04
C (N2O4)прореаг. = ½ C (NO2)образов. = 0,025 моль/л
C (N2O4)исх. = C (N2O4)прореаг. + C (NO2)равнов. = 0,025 + 0,04 = 0,065 моль/л
C (NO2)равнов. = [N2O4] = моль/л
Ответ: Kp = 0,0625 моль/л; C (N2O4)исх. = 0,025 моль/л.
Задача № 3. При повышении температуры от 200 C до 400 C скорость реакции, протекающей в организме, увеличилась в 6 раз. Вычислите температурный коэффициент.
Дано:
t1 = 200 C
t2 = 400 C
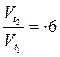 γ –?
γ –? 
| Решение. 
 ; ; 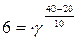 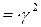 γ = √6 = 2,45
Ответ: γ = 2,45
γ = √6 = 2,45
Ответ: γ = 2,45
|
Задача № 4. Одним из продуктов радиоактивного распада при взрыве атомных станций является радиоактивный изотоп иод-131. В исследуемом образце его находилось 0,02 г. а) Какая часть изотопа останется в образце через месяц (в г и в %). б) Через какое время разложится 99% иода-131? τ0,5 (131I) = 8 сут?
Решение.
Дано:
τ = 30 суток,
а) С0 = 0,02
б)  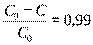 τ0,5 (131I) = 8 сут,
а) С –?
б) τ -?
τ0,5 (131I) = 8 сут,
а) С –?
б) τ -?
| Реакции радиоактивного распада относятся к реакциям 1 порядка:
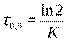 (1) (1)  (2), где
К – константа скорости радиоактивного распада,
С0 – исходная концентрация радиоактивного вещества,
С - концентрация радиоактивного вещества через время τ. (2), где
К – константа скорости радиоактивного распада,
С0 – исходная концентрация радиоактивного вещества,
С - концентрация радиоактивного вещества через время τ.
|
а) Из (1) находим К: 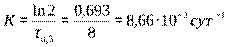
Из (2) находим С.
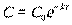 = 0,02·е-8,66·30 = 0,001486 (г) или
= 0,02·е-8,66·30 = 0,001486 (г) или 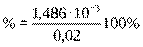 = 7,43%
= 7,43%
Ответ: через 30 суток в образце останется 1,486 · 10-3 г изотопа иода -131, или 7%.
б) 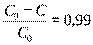 , отсюда С= 0,02 - 0,99х0,02 = 2·· 10-4 г.
, отсюда С= 0,02 - 0,99х0,02 = 2·· 10-4 г.
(2) 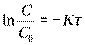 ;
; 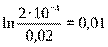 ;
; 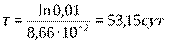
Ответ: через 53,15 суток разложится 99% иода-131.
Задача № 5. Взаимодействие оксида углерода (II) с хлором выражается уравнением:
СО + Сl2 = COCl2. Это простая реакция. Концентрация оксида углерода (II) равна 0,3 моль/л, а хлора - 0,2 моль/л. Как изменится скорость прямой реакции а) если увеличить концентрацию оксида углерода (II) до 1,2 моль/л, а концентрацию хлора до 0,6 моль/л? б) когда прореагирует 75% хлора.
Дано:
С0 (СО) = 0,3 моль/л
С0 (Сl2) = 0,2 моль/л
a) С1 (СО) = 0,3 моль/л
С1 (Сl2) = 0,2 моль/л
б) ω (Сl2)прореаг. =75% = 0,75
V1 –?  V2 –?
V2 –?
| Решение.  Скорость реакции взаимодействия оксида углерода (II) с хлором будет выражаться уравнением:
V0 = k · C0 (СО) · C0 (Cl2)
а). По условию задачи концентрация оксида углерода (II) была увеличена в 4 раза, а концентрация хлора - в 3 раза, поэтому для новых условий
V1 = k · 4C0 (СО) · 3C0 (Cl2) = 12 · k · C(СО) · C(Cl2)
Отсюда следует, что скорость данной реакции увеличится в 12 раз.
Скорость реакции взаимодействия оксида углерода (II) с хлором будет выражаться уравнением:
V0 = k · C0 (СО) · C0 (Cl2)
а). По условию задачи концентрация оксида углерода (II) была увеличена в 4 раза, а концентрация хлора - в 3 раза, поэтому для новых условий
V1 = k · 4C0 (СО) · 3C0 (Cl2) = 12 · k · C(СО) · C(Cl2)
Отсюда следует, что скорость данной реакции увеличится в 12 раз.
|
б) С (Cl2)прореаг. = С0 (Сl2) · ω (Сl2)прореаг = 0,2 · 0,75 = 0,15 моль/л
C(Cl2)ост. = С2 (Cl2) = С0 (Сl2) – С (Cl2)прореаг = 0,2 – 0,15 = 0,05 моль/л
По уравнению реакции:
С (CО)прореаг = С (Cl2)прореаг = 0,15 моль/л
C(CО)ост. = С2 (CO) = С0 (СО) – С (CО)прореаг = 0,3 – 0,15 = 0,15 моль/л
V2 = k · C2 (СО) · C2 (Cl2) = k · 0,15 · 0,05 = 0, 0075 k
V0 = k · C0 (СО) · C0 (Cl2) = k · 0,3 · 0,2 = 0, 06 k
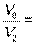
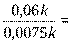 8
8
Ответ: скорость реакции уменьшится в 8 раз.
Лабораторная работа
Исследование зависимости скорости реакции разложения тиосерной кислоты от концентрации реагирующих веществ и температуры.
См. методическое руководство к практикуму по общей химии стр.42-44.
Цель работы: 1) приобрести навыки исследования кинетики химических реакций;
1) приобрести навыки изучения зависимости скорости реакции от температуры.
Оборудование: мерные цилиндры (мерные пробирки) на 10 мл (3 шт.), пробирки одинакового размера (диаметра) в штативе (10 шт.), секундомер.
Реактивы: растворы натрия тиосульфата с концентрацией 0,1 моль/л и серной кислоты с концентрацией 1 моль/л, вода дистиллированная.
Сущность работы:
Соли тиосерной кислоты термодинамически устойчивы и не разлагаются ни в твердом виде, ни в водных растворах. Сама же кислота неустойчива и сомопроизвольно разлагается с образованием сернистой кислоты и серы. Сернистая кислота также разлагается, образуя серы (IV) оксид и воду. Таким образом, реакция получения и разложения тиосерной кислоты состоит из следующих стадий:
S2O32- + 2H+ → H2S2O3 (очень быстро)
H2S2O3 → H2SO3 + S (медленно)
H2SO3 → SO2 + H2O (быстро)
Суммарное уравнение: S2O32- + 2H+ → S + SO2 + H2O
или в молекулярной форме
Na2S2O3 + H2SO4 → S + SO2 + H2O + Na2SO4
Скорость суммарного процесса определяется медленной стадией – разложением тиосерной кислоты: ϑ = k(cН2S2О3)n, n - кинетический порядок реакции.
Как видно из уравнения реакции, разложение натрия тиосульфата в кислой среде сопровождается выделением серы и раствор мутнеет. Время от начала опыта до достижения определенной степени помутнения раствора можно принять за время прохождения реакции. Чем меньше концентрация раствора натрия тиосульфата, тем больше будет этот промежуток времени (меньше скорость реакции). За скорость реакции можно условно принять величину, обратную времени протекания реакции: ϑ(усл) =1/ t.