ОБЩАЯ ХИМИЯ
Часть 1
Москва, 2016
ОГЛАВЛЕНИЕ
Электронное строение атома ………………………..…………..
Химическая связь…………………………………………………..
ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМА
Атом – мельчайшая структурная и химически неделимая частица. Все атомы состоят из атомного ядра и окруженной вокруг него электронной оболочки. Ядро состоит из нуклонов: протонов (положительно заряженные частицы p+) и нейтронов (нейтрально заряженные частицы n0) и имеет положительный заряд. Электронная оболочка состоит из энергетических уровней, представляющих собой совокупность орбиталей, на которых движутся электроны (отрицательно заряженные частицы е).
Для начала рассмотрим строение ядра атомов. Как уже описывалось, ядро состоит из протонов и нейтронов. Количество протонов, содержащихся в атоме того или иного химического элемента равно его порядковому номеру в периодической системе химических элементов Д.И. Менделеева. Чтобы найти число нейтронов, необходимо из относительной молекулярной массы химического элемента отнять число протонов.
Например, в атоме калия число протонов равно 19 (поскольку он имеет 19-ый номер в периодической системе химических элементов), а число нейтронов определяется разностью: 39 (относительная молекулярная масса калия) – 19 (число протонов) = 20.
Стоит заметить, что в атоме водорода отсутствуют нейтроны, поскольку его порядковый номер и относительная молекулярная масса равны 1.
Разновидности атомов, имеющих одинаковое число протонов, но разное число нейтронов называются изотопами. Наиболее распространен один из изотопов водорода – дейтерий, имеющий 1 нейтрон. Соединение с кислородом, которое образует дейтерий, называется тяжелой водой.
Более сложным является строение электронной оболочки атома. Орбитали, по которым движутся электроны, имеют разные формы. Наиболее простая орбиталь, s-орбиталь, имеет шарообразную форму. Следующая орбиталь, p-орбиталь, имеет форму гантели. Остальные орбитали представляют собой более сложные формы.
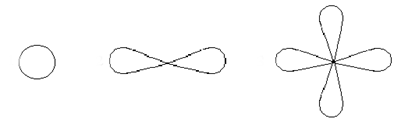
s-орбиталь p-орбиталь d-орбиталь
На каждом энергетическом уровне может находиться определенное число орбиталей и соответственно число электронов.
| Номер энергетического уровня | Вид орбиталей | Максимальное число электронов |
| S | ||
| s, p | ||
| s, p, d | ||
| s, p, d, f |
На любой орбитале могут находиться не более двух электронов, вращающихся в разном направлении. Начиная со второго энергетического уровня, во всех химических элементах присутствуют три p-орбитали (на каждом уровне, начиная со второго), а начиная с третьего энергетического уровня – пять d-орбиталей (на каждом уровне, начиная с третьего).
Число электронов в атоме равно числу протонов и каждый электрон можно описать с помощью набора квантовых чисел:
1) главное квантовое число – номер энергетического уровня, на котором располагается данный электрон. Обозначается «n ».
2) побочное квантовое число – форма орбитали, на которой располагается данный электрон. Обозначается «l ». Для s-орбитали оно равно 0, для p-орбитали – 1 и так далее.
3) магнитное квантовое число – положение орбитали в пространстве. Обозначается «ml ». Данное квантовое число принимает значение от –l до +l, включая 0.









s p d
0 -1 0 +1 -2 -1 0 +1 +2
4) спиновое квантовое число – магнитный момент, возникающий при вращении электрона вокруг собственной оси. Обозначается «mS ». Если электрон вращается по часовой стрелке, то спиновое квантовое число равно +1/2, а если против часовой стрелки -1/2.
Например, для электрона, изображенного на рисунке ниже, набор квантовых чисел будет такой: n = 3, l =1, ml = -1,
ms = +1/2.










3s 3p 3d
0 -1 0 +1 -2 -1 0 +1 +2
При заполнении электронами орбиталей энергетических уровней пользуются следующим принципом и правилами.
Принцип Паули.
Не существует двух электронов в атоме с одинаковыми наборами квантовых чисел, т.е. на одной орбитале не могут находиться два электрона с одинаковыми спинами.
Правило Хунда.
Электроны располагаются на одинаковых орбиталях таким образом, чтобы суммарный спин был максимальным, т.е. сначала заполняются все электроны с положительными значениями спиновых квантовых чисел, а затем - с отрицательным.