Если известны как функция температуры, удельная теплота испарения q удельные объемы V1 и V2, то уравнение  можно проинтегрировать и найти в явном виде зависимость давления насыщенного пара от температуры. В самом грубом приближении можно считать, что величина q не зависит от температуры, а удельным объемом жидкости по сравнению с удельным объемом пара можно пренебречь. Кроме того, можно считать, что к пару применимо уравнение состояния Менделеева-Клапейрона.
можно проинтегрировать и найти в явном виде зависимость давления насыщенного пара от температуры. В самом грубом приближении можно считать, что величина q не зависит от температуры, а удельным объемом жидкости по сравнению с удельным объемом пара можно пренебречь. Кроме того, можно считать, что к пару применимо уравнение состояния Менделеева-Клапейрона.
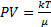



Постоянную интегрирования С можно найти, если известно давление насыщенного пара Р при какой-либо одной температуре Т.

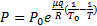
А) Зависимость давления насыщенного пара от кривизны поверхности жидкости.


А) Теплоёмкость насыщенного пара.
Первое начало термодинамики для единицы массы пара можно записать в виде  где
где  - удельная энтальпия и V-удельный объем пара. Мы применим это уравнение к процессу, в котором Р не остается постоянным. Однако если пар считать идеальным газом, то его энтальпия будет зависеть только от температуры.
- удельная энтальпия и V-удельный объем пара. Мы применим это уравнение к процессу, в котором Р не остается постоянным. Однако если пар считать идеальным газом, то его энтальпия будет зависеть только от температуры.
Тогда для любого квазистатического процесса 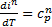 Поэтому для искомой теплоемкости насыщенного пара получаем
Поэтому для искомой теплоемкости насыщенного пара получаем 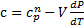
Поскольку нагревание производится так, что пар все время остается насыщенным, производная 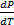 определяется формулой
определяется формулой 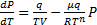 пользуясь которой, получаем
пользуясь которой, получаем 
Согласно классической теории молярной теплоемкости водяного пара при постоянном давлении равна 8 кал/(моль*К), а удельная теплоемкость  Теплота парообразования при Т=313К для воды q=539 кал/г
Теплота парообразования при Т=313К для воды q=539 кал/г
Пользуясь этими данными получаем по формуле
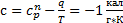 Теплоемкость «с» отрицательна. Значит при адиабатическом расширении насыщенного водяного пара он охлаждается и становится перенасыщенным.
Теплоемкость «с» отрицательна. Значит при адиабатическом расширении насыщенного водяного пара он охлаждается и становится перенасыщенным.
Пересы́щенный пар — пар, давление которого превышает давление насыщенного пара при данной температуре.
С) Что называют относительной влажностью воздуха?
Относительная влажность — отношение парциального давления паров воды в газе (в первую очередь, в воздухе) к равновесному давлению насыщенных паров при данной температуре.
С) Закон Дальтона.
Давление смеси химически не взаимодействующих идеальных газов ровно сумме их парциальных давлений.
Когда один и тот же объем занимает смесь газов, (2 газа и более), то полное давление смеси равно сумме парциальных давлений отдельных газов, из которых состоит смесь. Парциальное давление газа определяется как давление этого газа, если бы он один занимал весь объем.
Каждый газ в смеси создает парциальное давление, пропорциональное его молекулярной концентрации.
Это положение согласуется с законом идеального газа, из которого следует, что полное давление



В) Вывести расчётную формулу для метода, используемого в работе.


А) Что называют подвижностью частицы? Получить соотношение Эйнштейна между
Диффузией и подвижностью частицы.



А) Термическая диффузия. Вывод формулы для разделения. Применение термической
Диффузии для разделения изотопов.


