СЛАЙД № 1
Потребность в углеводах, жирах, белке в питании, г/сут.
| Группа | Пол | Потребность | ||
| в угле-водах | в жирах | в белке | ||
| Работники, не связанные с физическим трудом | М | 87 (26) – раст. жиры | 92 (55) - животный белок | |
| Ж | 73 (22) | 78 (47) | ||
| Работники механизированного труда | М | 94 (28) | 95 (52) | |
| Ж | 79 (24) | 80 (45) | ||
| Работники тяжелого немеханизированного труда | М | 145 (43) | 132 (66) | |
| Студенты | М | 106 (32) | 113 (68) | |
| Ж | 90 (27) | 96 (58) |
Могут быть значительные отклонения от средних величин в зависимости от условий труда, быта, возраста, климата и т.д. При тяжелой физической работе » 500 – 600 г углеводов.
2) Пластическая (источник С).
Из углеводов в организме синтезируются соединения других классов: заменимые аминокислоты, липиды, нуклеиновые кислоты и т.д.
3) Строительная.
Углеводы являются структурными компонентами клеточных стенок.:
а) растений (целлюлоза);
б) бактерий (мурин);
в) грибов (хитин);
г) клеточных мембран всех живых организмов (в виде комплексов углеводов с белками, которые называются гликопротеины).
Кроме основных они выполняют ряд отдельных функций. Например:
1) специфические вещества, обуславливающие групповые особенности крови, также относятся к гликопротеинам;
2) в состав многих тканей и органов входят комплексы углеводов с липидами – гликолипиды (особенно ими богат головной мозг);
3) гепарин – препятствующий свертыванию крови – также производное углеводов.
Широко используют углеводы в медицинской практике:
1) 5 % раствор глюкозы используют как изотонический р-р;
2) 10 – 40 % р-р глюкозы – гипертонический р-р;
3) высокомолекулярные углеводы – декстран, синкоп и др. как кровезаменители;
4) углеводы и их производные составляют большую группу лекарственных веществ (например, гликозиды).
Классификация углеводов
СЛАЙД № 2
Углеводы составляют обширную группу соединений, различаются отношением к гидролизу.
Моносахариды – простейшие углеводы, не гидролизующиеся с образованием более простых углеводов.
Сn(H2O)n С6Н12О6 (С6(Н2О)6)
глюкоза фруктоза
Моносахариды - это гетерофункциональные соединения, содержащие оксогруппу и несколько гидроксильных групп.
Моносахариды можно рассматривать как производные многоатомных спиртов, содержащих карбонильную (альдегидную или кетонную) группу.
Поэтому моносахариды классифицируются с учетом 2-х признаков:
1) природы оксогруппы;
2) длины углеродной цепи (от 3 до 10 атомов углерода).
Имеют окончание – оза.

Стереоизомерия моносахаридов
Стереоизомерами называются изомеры, различающиеся только расположением атомов и групп атомов в пространстве.
Стереоизомеры моносахар. Д ряда, отличающиеся конфигурацией одного или нескольких (но не всех) атомов углерода, и не относящиеся друг к другу, как предмет и его зеркальные отражения, называются диастереомерами.
Диастереомеры имеют различные физические и химические свойства.
Общее число стереоизомеров: N = 2n, где n – число асимметричных атомов углерода. Например, в альдогексозе имеется 4 хиральных центра.
24 = 16 стереоизомеров (8 пар энантиомеров)

Хиральный центр или ассиметричный атом С – это атом, связанный с 4-мя различными атомами или группами атомов.
Например, в альдогексозах имеется 4 хиральных центра.
24 = 16 стереоизомеров (8 пар энантиомеров)
Относительная конфигурация моносахаридов определяется по конфигурационному стандарту - глицериновый альдегид (Розанов, 1906 г.).
СЛАЙД № 3
Классификация стереоизомеров.

Д+ - глиц. альдегид L- - глицнральдегид
Знак вращения плоскости поляризации света монасахаридами определяется экспериментально.

Энантиомеры – стереоизомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение.
Они имеют одинаковые физические, химические свойства (to пл., to кип., одинаковая растворимость, реагируют с одинаковым объемом), но обладают разной оптической активностью. Энантиомеры способны вращать плоскость поляризации света по разному: один левовращающий (-), другой правовращающий (+), хотя абсолютное значение углов одинаково.
Величину и знак угла вращения хиральных соединений нельзя предсказать, они определяются экспериментально с помощью приборов поляметров.
Смесь равных количеств энантиомеров 50: 50 называется рацематами. Рацематы не обладают оптической активностью (±).
Например:
а) (+) Изопропиладреналин (изадрин) проявляет в 800 раз более сильное бронхорасширяющее действие, чем его левовращающий энантиомер.
б) Лекарственное средство противоопухолевого действия – сарколизин – является левовращающим энантиомером; (+) сарколизин не активен.
Таким образом, биологическое действие биорегуляторов (гормоны, витамины, антибиотики и др.) и лекарственных веществ принципиально связано с пространственным строением их молекул.
Большинство природных моносахаридов принадлежит к Д-ряду и организмом усваиваются углеводы только Д-ряда.
Диастереоизомерами называются стереоизомеры, не являющиеся энатиомерами.
Эпимерами называются диастереомеры, различающиеся конфигурацией только одного углеродного атома (частный случай диастереомеров).
СЛАЙД № 4

Цикло-оксо-таутомерия.
Исходя из оксоформы (моносахариды с открытой незамкнутой цепью) нельзя было объяснить три особенности свойств моносахаридов.
1) Не все реакции характерные для альдегидов, характерны для моносахаридов.
2) Один гидроксил особый: при взаимодействии альдогексоз с СН3ОН (НС1 сух.) вступает в реакцию лишь этот гидроксил.
3) Для свежеприготовленных растворов моносахаров характерно явление мутаротации – это изменение во времени угла вращения плоскости поляризации света свежеприготовленными р-рами.
Все эти явления можно объяснить, если учесть, что главная форма моносахаров – циклическая.
Московский ученый проф. М.А. Колли (1870 г.) и немецкий ученый Толленс (1883 г.) подтвердили циклическую структуру моносахаров. sp3 вал. угол 109,5о, поэтому 5 и 6-ти углеродные цепи могут иметь клешневидную конформацию. Отсюда – сближение в пространстве альд. группы (или кетонной) и гидроксильной группы С-5 или С-4 (реакция АN – образуется циклич. полуацеталь).
СЛАЙД № 5

Возникает дополнительный центр хиральности – аномерный, а соответ. 2 стереоизомера - a и b-аномерами.
Ф-лы Хеуорса.

Поэтому в кристаллическом состоянии моносахара на 100 % находятся в циклической форме. При растворении » 0,02 % переходят в оксоформу. В водных растворах моносахаров (и большинство известных дисахаридов) устанавливается равновесие между их разными формами: цикло- и оксо, фуранозными и пиранозными, а также между a- и b-формами.
Таутомерия – это равновесная динамическая изомерия, когда одновременно сосуществуют открытая и циклическая формы (таутомеры). Такой вид таутомерии называют цикло-оксо-таутомерией.
СЛАЙД № 6

Химической основой мутаротации является способность моносахаридов к цикло-оксо-таутомерии (пока не установится равновесие, р-ры мутаротируют). Моносахариды в действительности не имеют плоского строения, пиранозные циклы принимают выгодную конформацию – кресла.
СЛАЙД № 7



Физические и химические свойства.
Моносахариды – твердые, бесцветные кристаллические вещества, хорошо растворимые в воде, плохо - в спирте и органических растворителях.
Большинство имеют сладкий вкус, если у сахарозы принять за 100 %, то у фруктозы – 73 %, лактозы – 16 %, ксилозы – 40 %, глюкозы – 74 %.
Водные растворы имеют нейтральную среду.
В свободном виде в природе встречается глюкоза, остальные моносахара как компоненты ди-и полисахаридов. Как гетерофункциональные соединения обладают свойствами: 1) альдегидов и кетонов; 2) многоатомных спиртов; 3) особые обуславливаются гетерофунк.
Химические свойства:
1) Образование гликозидов.
При взаимодействии со спиртами, фенолами (НС1 сух.) образуются производные циклической формы только по гликозидной группе ОН – циклические ацетали – гликозиды.
СЛАЙД № 8
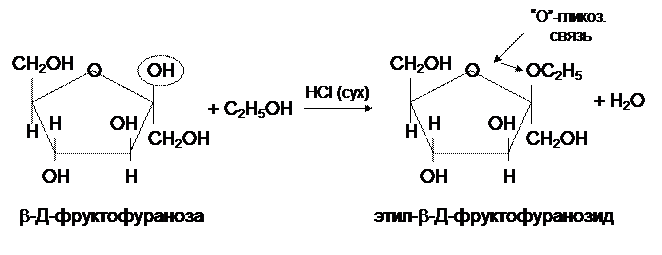
Окончание – оза на - озид.
Растворы гликозидов не мутаротируют (это очень сложный процесс). Они легко гидролизуются разбавленными кислотами, но устойчивы к гидролизу в слабощелочной среде.

2) Простые эфиры.
Алкилгалогениды (CH3I, C2H5I или (CH3)2SO4).
СЛАЙД № 9


Простые эфирные связи не гидролизуются, в то время как О-гликозидная связь гидролизуется в (Н+).
3) Сложные эфиры.
Все гидроксильные группы моносахаров образуют сложные эфирные связи с ангидридами карбоновых кислот (уксусным ангидридом), фосфорной кислотой. Особое значение имеют фосфаты (метаболизм углеводов, фотосинтез и др. биологические процессы осуществляются с участием фосфатов).
СЛАЙД № 10

Сложные эфиры гидролизуются как в кислой, так и в щелочной среде.
4) Восстановление (свойства альдегидов и кетонов), (+Н2, катион Ni или Pd) ® многоатомные спирты (сладкий вкус), поэтому заменители сахара при сахарном диабете.
ксилоза ® ксилит
глюкоза ® сорбит
манноза ® маннит
галактоза ® дульцит
СЛАЙД № 11
5) Реакции окисления.
Окисление альдоз в нейтральной и кислой среде позволяет сохранить углеродный скелет.
а) получение «оновых» кислот (альдоновые, гликоновые) мягкими окислителями Вг2 (aq).

б) получение «аровых» кислот (гликаровые, сахарные).
СЛАЙД № 12

в) получение «уроновых» кислот (гликуроновые к-ты).
1) «защита» альдегидной группы
СЛАЙД № 13

Важную биологическую роль выполняет Д-глюкуроновая кислота (многие токсичные вещества выделяются с мочой в виде глюкуронидов (процесс дезоинтоксикации). Уроновые кислоты способны к декарбоксилированию (-СО2) под влиянием солей некоторых Ме или под влиянием микроорганизмов.
Гексуроновые кислоты ® пентозы
СЛАЙД № 14

Окисление в щелочной среде.
Используются в биохимических анализах для обнаружения моносахаридов (в частности глюкозы) в биологических жидкостях (моча, кровь).