ЗАНЯТИЕ №7. ОСНОВЫХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ.
ТЕРМОХИМИЯ. ЗАКОН ГЕССА. ЭНТРОПИЯ. ЭНЕРГИЯ ГИББСА.
Необходимый базовый уровень:
1) тепловой эффект химической реакции
2) экзотермические и эндотермические реакции
3) типы термодинамических процессов: изотермические, изобарные, изохорные.
Вопросы для подготовки к занятию:
1) Основные понятия термодинамики. Функция состояния. Внутренняя энергия. Работа и теплота - две формы передачи энергии.
2) Типы термодинамических систем (изолированные, закрытые, открытые). Стандартное состояние.
3) Первый закон термодинамики. Энтальпия. Стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Стандартная энтальпия реакции.
4) Закон Гесса и его следствия. Применение первого начала термодинамики к биосистемам.
5) Второй закон термодинамики. Обратимые и необратимые в термодинамическом смысле процессы. Энтропия.
7) Энергия Гиббса. Прогнозирование направления самопроизвольно протекающих процессов в изолированной и закрытой системах; роль энтальпийного и энтропийного факторов. Термодинамические условия равновесия.
8) Стандартная энергия Гиббса образования вещества. Стандартная энергия Гиббса реакции. Примеры экзергонических и эндергонических процессов, протекающих в организме.
9) Химическое равновесие. Обратимые и необратимые по направлению реакции. Константа химического равновесия. Термодинамические условия равновесия в изолированных и закрытых системах.
10) Уравнения изотермы химической реакции. Прогнозирование смещения химического равновесия.
ЛАБОРАТОРНАЯ РАБОТА:
Опыт №1. Смещение химического равновесия при изменении концентрации реагентов.
Опыт №2. Смещение химического равновесия при изменении температуры.
НА ЗАНЯТИИ БУДЕТ ПРОВЕДЕН ВХОДНОЙ ТЕСТ-КОНТРОЛЬ!
Задачи и упражнения для самоподготовки
1. В 100 г трески в среднем содержится 11,6 г белков и 0,3 г жиров. Определить калорийность порции трески массой 200 г. Ответ: 103,02 ккал.
2. Тепловой эффект реакции SО2(г) + 2Н2S(г) = 3S(т) + 2Н2О(ж) равен 234,5 кДж. Определите стандартную теплоту образования Н2S (г), если DНобр (SО2)г = -297 кДж/моль, DНобр (Н2О)ж = -286 кДж/моль. Ответ: -20,25 кДж/моль.
3. Теплота сгорания глюкозы равна 2816 кДж/моль, теплота сгорания этанола равна 1236 кДж/моль. Рассчитайте тепловой эффект биохимического процесса брожения глюкозы. Ответ: 344 кДж/моль.
4. Не производя расчета, установите знак изменения энтропии в следующих реакциях:
С15Н31СООН(т) + 23О2(г) = 16СО2 + 16Н2О
2СН3ОН(г) + 3О2(г) = 4Н2О(г) + 2СО2(г)
5. Рассчитайте DS реакции АТФ + Н2О = АДФ + Ф при 370С. (DG и DН реакции составляют –30,9 и 20,1 кДж/моль соответственно). Ответ: 0,16 кДж/моль.
6. Вычислить значения DG следующих реакций восстановления оксида железа (II):
а) FеО (т) + СO = Fе (т) + СО2 (г) D G 0(FeO) = –244 кДж/моль; D G 0(СO) = –137 кДж/моль;
б) FеО (т) + С (графит) = Fе (т) + СО2 (г) D G 0(СO2) = –394,4 кДж/моль.
Протекание какой реакции наиболее вероятно?
7. Какое значение имеет DG, если константа равновесия при 298 Кр= 1. Какое значение имеет константа равновесия при 298 К, если DG = 0.
8. Условие, вызывающее смещение равновесия в сторону обратной реакции (влево):
CO2 + C(т) Û 2CO – Q
1) увеличение концентрации углерода; 2) охлаждение; 3) повышение концентрации оксида углерода (IV);
4) понижение давления
9. Константа равновесия реакции тепловой денатурации химотрипсиногена при рН 2 и 50оС равна 32,7. Вычислите значение стандартной энтальпии процесса, если известно, что DSo = + 1,32 кДж (моль×К). Ответ: 417 кДж/моль.
Литература
1. Общая химия. Биофизическая химия. Химия биогенных элементов/Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник; Под ред. Ю.А. Ершова.- 3-е изд., стер.-М.: Высш. шк., 2002.-С.10-42.
2. В.А. Попков, С.А. Пузаков. Общая химия.- М.: ГЭОТАР-Медиа, 2007-С.150-199.
3. Руководство к практическим занятиям по общей химии: Методические разработки к выполнению лабораторных работ.-Ч.I / Сост. А.П. Коровяков, П.В. Назаров, Г.Б. Замостьянова и др.-Ижевск, 2004.- С. 15-19.
Для гомогенных обратимых реакций закон действия масс устанавливает: при постоянной температуре отношение произведения равновесных концентраций продуктов реакций к произведению равновесных концентраций исходных веществ есть величина постоянная (Гульдберг, Вааге, 1864).
Например, для реакции
А2(г) +B2(г) ®2AB(г)
Закон действия масс запишется так:
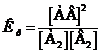 , где К р – константа равновесия.
, где К р – константа равновесия.
Для реакции в общем виде: aA + bB Û cC + dD величина П с имеет вид:
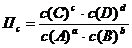
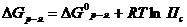 – уравнение изотермы Вант-Гоффа.
– уравнение изотермы Вант-Гоффа.
Данное уравнение описывает изменение энергии Гиббса, происходящие в результате превращения реагентов при определенных условиях в продукты реакции, находящихся при некоторых других условиях. Нетрудно заметить, что дробь в правой части уравнения имеет такой же вид, как и выражение для константы равновесия в законе действия масс.
Однако эта дробь будет действительно совпадать с выражением для константы равновесия только при условии, что все находящиеся в нем концентрации соответствуют равновесным условиям.
Если они соответствуют этим условиям, то из 2 закона термодинамики следует, что для состояния равновесия: DG=0, дробь будет равна константе равновесия:
DG0р-я= - RT ln Кс - уравнение изотермы химической реакции при состоянии равновесия.
В экспоненциальном виде: 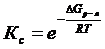 .
.
После подстановки DG0р-я= – RT ln Кс в уравнение изотермы получим:
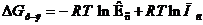 или
или 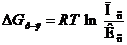
ВЛИЯНИЕ РАЗЛИЧНЫХ ФАКТОРОВ НА ХИМИЧЕСКОЕ РАВНОВЕСИЕ
1. Влияние концентрации. Для того чтобы посмотреть, как влияет концентрация, приведем уравнение: 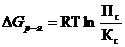 .
.
а) если в систему с установившимся равновесием добавить исходное вещество, то Пс<Кс, т.е. Пс/Кс<1. В системе будет идти реакция вправо, пока снова не установится равновесие;
б) если в систему с установившимся равновесием добавить один из продуктов реакции, то Пс>Кс, т.е. Пс/Кс>1. В системе будет идти реакция влево.
2. Влияние температуры. Вспомним уравнение 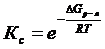 . Также нам известно,
. Также нам известно, 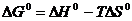 . Подставим это уравнение в уравнение изотермы реакции:
. Подставим это уравнение в уравнение изотермы реакции:
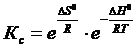 .
.
При эндотермическом процессе (DН>0) с увеличением температуры К с возрастает, т.е. равновесие смещается вправо.
При экзотермическом процессе (DН<0) c увеличением температуры Кс убывает, т.е. равновесие смещается влево.
Общий принцип – принцип Ле-Шателье: если на систему, находящуюся в состоянии равновесия оказать внешнее воздействие, то равновесие смещается в сторону уменьшения этого воздействия.