Предисловие.
Будучи огорчен горд и всячески доволен качеством преподавания химии в РНИИМУ, и тем более, способом последующего контроля качества образования – тестами, я решил оказать посильную помощь студентам в сдаче оных. Пособие представляет собой краткую, насколько возможно, инструкцию, как минимально загрузив голову таки сдать этот окаянный тест. Я исследовал большое их количество, обобщил результаты.
На каждый вид вопросов я постарался дать ответ, в меру научный, чтобы все-таки не слишком уйти от своих химических корней, но и достаточно ясный, чтобы он мог быть воспринят среднестатистическим студентом. Теперь я представляю свой труд для использования широкой общественностью, надеюсь, моё творение сможет послужить к чьей-нибудь пользе.
Конечно, многим хотелось бы иметь готовые ответы и не париться. Думаю, что за годы работы eois общественность накопила некоторый объем ответов, он постепенно совершенствуется, доля верных ответов растет, уже в 2016 она была больше 70%. Правда, обновление вопросов в 2017 добавило веселья. Однако, в отношении химии мне это кажется неудачным путем. Объясню, почему я так считаю. Во-первых, вопросов большое количество, и они, как назло, очень похожи. Это делает трудным списывание с правильных ответов, и, одновременно, делает тесты уязвимыми к методичкам вот такого плана, с разбором вопросов на группы и злой иронией по этому поводу. Во-вторых, некоторые персонажи, как Карина, например, почему-то борются со списыванием, что делает этот процесс не самым простым трюком. А глядя на всё это глобально, по-моему, все же лучше что-то понимать и мыслить, чем списывать.
Заранее благодарен за адекватные комментарии, дополнения и исправления к тексту. Текст создан исключительно из гуманных соображений и распространяется безвозмездно.
|
|
Удачи, ни пуха, ни пера, дорогие любители химии.
Алексей «Леша-химик» Федоров,
??.??.2017. – 18.09.2021.
Тема 4. Химическое равновесие. Кинетика.
Кинетика теперь – отдельная тема
Введение: Наконец-то химическое равновесие отделили от химической кинетики. Это должно пойти на пользу всем. Из формул нам понадобится теперь только одна:
1) Константа равновесия

Кс — константа химического равновесия, […] — концентраци того, что указано, если веществ несколько, то они перемножены, коэффициенты как степени. Формула подстраивается под реакцию, например,
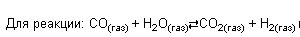
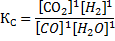
Стоит учитывать, что если в реакцию входят твердые вещества или жидкости вместе с газами, то их (твердых и жидких) концентрации не учитываются в константе (потому что у твердых веществ нет концентрации). И так далее.
Типичные вопросы:
1. Порочная связь энергии Гиббса и константы равновесия.
Пример:

…
Как с этим бороться:
Довольно несложно. Мы тут вам свели все возможные варианты в таблицу, пользуйтесь на здоровье:
| Гиббс | Разная фигня | Ещё фигня | Константа | Направление |
| ΔG0 = 0 | ΔH0 = T∙ΔS0 | ΔH0 - T∙ΔS0 = 0 | Кс = 1 в стандартных условиях | Состояние химического равновесия в стандартных условиях |
| ΔG = 0 | ΔH = T∙ΔS | ΔH - T∙ΔS = 0 | Кс = 1 | Состояние химического равновесия |
| ΔG0 < 0 | ΔH0 <T∙ΔS0 | ΔH0 - T∙ΔS0 < 0 | Кс >1 в стандартных условиях | Идёт прямая реакция в стандартных условиях |
| ΔG0 > 0 | ΔH0> T∙ΔS0 | ΔH0 - T∙ΔS0 > 0 | Кс <1 в стандартных условиях | Идёт обратная реакция в стандартных условиях |
| ΔG < 0 | ΔH <T∙ΔS | ΔH - T∙ΔS < 0 | Кс > 1 | Идёт прямая реакция |
| ΔG > 0 | ΔH > T∙ΔS | ΔH - T∙ΔS > 0 | Кс < 1 | Идёт обратная реакция |
|
|
Обратим внимание на маленький ноль – он означает стандартные условия, его отсутствие – отсутствие ссылки на стандартные условия.
Также иногда можно встретить вариацию на тему данного вопроса:

Которая решается сведением к той же таблице. Кс > 1 означат прямую реакцию, а Кс < 1 – обратную реакцию в стандартных условиях.
2. Концентрация и сдвиг равновесия.
Пример:

Верните мне мой 2017…

Спасибо, вернули. Реакций на одну больше но ладно.
Как с этим бороться:
Заурядно. Зависимость такая:
При увеличении концентрации исходного равновесие смещается вправо.
При увеличении концентрации продукта равновесие смещается влево.
Короче говоря, в виде значков
↑С(исх) => равновесие→
↑С(прод) => равновесие ←
Еще короче, равновесие смещается в сторону от той части, в которой увеличивают концентрацию, или равновесие смещается в ту сторону, где уменьшают концентрацию.
При уменьшении концентраций эффект очевидно будет обратным. Теперь главное понять, вещество, про которое спрашивают, исходное или продукт? Например, в старой задаче, приведённой первой, хотят, чтобы уменьшение водорода смещало влево. Значит, водород должен быть слева. Или, по-другому, водород должен быть исходным веществом. Подходит только D. Во второй задаче увеличение концентрации водорода должно сместить равновесие влево. Значит, водород должен быть справа и быть продуктом. Не путайте увеличение и уменьшение концентраций.
|
|
3. Температура и константа равновесия.
Пример:
И снова верните мне мой 2017…

Почти вернули. Снова ΔH<0, снова понижение температуры, хотя реакция отвалилась, и писать теперь надо руками…
Как с этим бороться:
Похоже на предыдущую задачу, но много более занудно. Для краткости приведем таблицу:
| H: | Температура | равновесие | Константа равновесия |
| ΔH>0 Эндотермическая | Повышение ↑ температуры | Вправо → | Увеличится↑ |
| Понижение ↓ температуры | Влево ← | Уменьшится↓ | |
| ΔH<0 Экзотермическая | Повышение ↑ температуры | Влево ← | Уменьшится↓ |
| Понижение ↓ температуры | Вправо → | Увеличится↑ |
Из трех факторов: ΔH, температура и равновесие (или константа) должно быть дано два, третий находится по соответствию. В приведенных примерах сказано, что Т↓, и при этом ΔH<0. Находим в таблице такую строку, видим, что константа увеличится. Может быть дано изменение константы и температуры, и запрошено ΔH, делается так же, только в обратном порядке.
4. Температура и сдвиг равновесия влево-вправо.
Пример:

Не надо смотреть на реакции. Не смотри на реакции, дурак. Только Н.
Как с этим бороться:
Еще раз таблица, приведённая в прошлом типе вопросов. Указано, что в зависимости от ΔН и Т константа или увеличивается или уменьшается, а равновесие смещается влево или вправо. Зная, например, из условия что температура понижается, а равновесие должно сместиться влево, ясно что нужно выбрать реакции с ΔН>0, ответ 1,2,4.
5. Давление и сдвиг равновесия влево-вправо.
Пример:

Все мы находимся под большим давлением…
Как с этим бороться:
Из принципа Ле-Шателе следует, что при увеличении давления равновесие смещается в сторону образования меньшего числа газообразных продуктов (считая по коэфициентам). Короче говоря:
↑Р = меньше газов
↓Р = больше газов
Газов поровну = давление не влияет
Конечно, в разных реакциях больше газов может быть и в исходных веществах, и в продуктах. Некоторые реакции содержат одинаковое число молекул газов в исходных и продуктах, на такие реакции изменение давления влиять не будет. Это 1,2 и 4 реакции. Газов может быть и ноль, это тоже число. Обращайте внимание на состояния, они указаны. Жидкие и твердые вещества считать не нужно.
6. ККККККККОООМБО из температуры и давления.
Пример:

Комбо-вомбо…
Как с этим бороться:
Рассматриваем каждый параметр по отдельности. Сначала температура. Если ΔН<0, а температура понижается, то равновесие сместится вправо (ебучая таблица). Теперь давление. Газов тут нет нигде, значит давление на эту реакцию не влияет. Общее влияние обоих факторов – (вправо + не влияет) = вправо. Не надо стесняться писать «нельзя определить». Когда один фактор двигает равновесие вправо, а другой влево, этот ответ является верным.
7. Выражения констант равновесия.
Пример:

Сложное говно.
Как с этим бороться:
Довольно сложный вопрос, построенный на знании математики. В общих чертах понятно, что константа равновесия равна [продукты] делить на [исходные вещества], в степенях равных коэффициентам. Для реакции PCl3 + Cl2 = PCl5, например
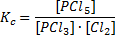
Наверное, если прочитать условия, то так и быть, можно понять, что
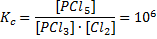
Это значит, что 2 формула верная (дроби хорошо бы писать не «/», а нормально, но это уже капризы).
Дальше начинается адская кутерьма с математикой, которая заключается в том, чтобы что-то выразить из этой формулы, и посмотреть, сходится или нет. Для этого хорошо подходит т.н. «блондиночный» метод, описанный в методичке про концентрации.
Выразим [PCl3]*[Cl2]. Для этого временно в уме заменим буквы на цифры:
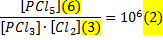
Любому очевидно, что 6/3=2. Если бы хотели выразить 3, то написали бы 3 = 6/2. А теперь вернёмся к буквам
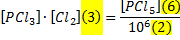
У нас получилось то же выражение, что приведено в п. 1. Значит, оно верно. Также наше выражение не совпало с п. 3., значит оно ложно. Это кропотливая и сложная работа, но выхода нет. Маленький лайфхак – выражения с «+», как п. 4, никогда не могут быть верными – нужно только умножение.
8. Задача про направление процесса.
Пример:

Легкий пример…
Как с этим бороться:
Для этого нужно посчитать величину Пс. Эта самая Пс считается точно так же, как Кс, однако есть нюанс. В Кс концентрации равновесные (конечные), а тут текущие (исходные). Если нюанс непонятен, унывать не надо. Просто брать что дано и считать. Просто считаем Пс:
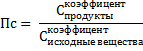
Рассчитанную величину сравнивают с данной Кс. Если
Пс > Kc, реакция идёт влево
Пс < Kc, реакция идёт вправо.
Пс = Kc, реакция не идёт, состояние равновесия.
В скрине:
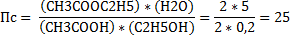
Рассчитанное сравниваем: Пс=25 (расчет) > Кс=4 (дано), реакция идёт влево. Считайте внимательно. Пишите аккуратно, должно получиться что-то типа «25 влево»
9. Верно-неверно.
Пример:

Блядская хуйня умудрилась попасться и тут но почему-то не всем…
Как с этим бороться:
Данный тип вопросов попадается и тут, но почему-то не в каждом варианте. Некоторым людям такое не достаётся, что весьма странно и не очень справедливо. Как обычно, могу лишь сказать, что это не ваше, смиритесь. И дать перечень верных утверждений.
· Константа равновесия зависит от природы вещества и температуры и не зависит от давления, концентраций и катализаторов.
· В состоянии химического равновесия скорости прямой и обратной реакции, измеренные по одному веществу таки равны
· При повышении температуры равновесие смещается в сторону эндотермической реакции, при понижении температуры – экзотермической.
· При повышении давления равновесие смещается в сторону образования меньшего числа моль газообразных продуктов.
· При увеличении концентрации исходного – вправо, продукта – влево.
· В состоянии равновесия энергия Гиббса таки равна нолю.
· Состояние равновесия может сохраняться бесконечно долго при сохранении параметров Т и Р.
· Катализатор увеличивает скорость прямой и обратной реакции, но не влияет на Кс.
· В выражение константы гетерогенного равновесия не входят концентрации веществ находящиеся в более конденсированной фазе (блять кто это придумал).
· Там точно больше, что именно - х.з.
10. Ебанутая задача aka Константа равновесия и разные выражения.
Пример:

В кафедральных материалах…

В естественной среде обитания
Как с этим бороться:
В общем довольно сложно. Разделим задачи на группы.
1. Нужно просто посчитать Кс, и всё что нужно есть. Пример – задача №1. У нас есть формула Кс
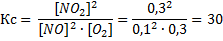
Это легко и может сделать любой дурачок.
2. Даны исходные и/или равновесные концентрации и нужно посчитать исходную и/или равновесную концентрацию или Кс. Пример – задачи № 2, 3 и 4 и пример из теста. Решим №2. Для этого сведём всё, что дано в таблицу. Столбики – по количеству веществ, строки – 3
2 NO + O2 = 2 NO2
сначала получится вот так:
| NO | O2 | NO2 | |
| Было /исходная | |||
| Прореагировало | |||
| Осталось/равновесная | 0,4 | 0,1 | 0,4 |
Потом заполняем строку «прореагировало» иксами. Исходные вещества добавляем минус, продукты +, если есть коэффициенты – добавляем их. Получится вот так:
| NO | O2 | NO2 | |
| Было /исходная | |||
| Прореагировало | -2Х | -Х | +2Х |
| Осталось/равновесная | 0,4 | 0,1 | 0,4 |
У нас получился полный столбик в NO2, где написано что
0+2Х=0,4
откуда очевидно, что
Х=0,2
Поскольку Х одинаковый, то мы можем скопировать его в другие столбики:
| NO | O2 | NO2 | |
| Было /исходная | |||
| Прореагировало | -0,4 | -0,2 | +0,4 |
| Осталось/равновесная | 0,4 | 0,1 | 0,4 |
Теперь легко понять, что исходно NO должно было быть 0,8 (потому что 0,8-0,4=0,4), а О2 должно было быть 0,3 (потому что 0,3-0,2=0,1). Нужно было найти исходный NO, значит ответ 0,8.
Задача №3 немного сложнее, попробуйте сами. Это гибрид №1 и №2. В №4 написано про 50% прореагировало. Это значит, что осталось тоже 50%. Если исходная концентрация была = 4, то равновесная = 4*0,5 = 2, то есть 50% от 4. Затем задача сводится к такой же таблице. Если бы прореагировало например 70%, то осталось бы 30% и равновесная концентрация (то есть то, что осталось) = 4*0,3 = 1,2 (30% от 4).
3. Даны Кс (!), исходные и/или равновесные концентрации и нужно посчитать исходную и/или равновесную концентрацию. Пример – задачи № 5 и 6. Решим №5. Для этого снова сведём всё, что дано в таблицу. У твёрдых веществ, напомню, нет концентрации
| СO | СO2 | |
| Было /исходная | 0,45 | |
| Прореагировало | ||
| Осталось/равновесная |
Данных маловато, но при этом Кс = 2. Можно так же заполнить строку прореагировало иксами:
| СO | СO2 | |
| Было /исходная | 0,45 | |
| Прореагировало | -Х | +Х |
| Осталось/равновесная |
Полных столбиков не получается, хотя Кс всё ещё равно 2. Поскольку нормально заполнить таблицу не получилось, заполним её по-уебански очевидно а затем используем Кс, не зря ж она дана:
| СO | СO2 | |
| Было /исходная | 0,45 | |
| Прореагировало | -Х | +Х |
| Осталось/равновесная | 0,45-Х | 0+Х |
По определению Кс она равна равновесные концентрации продуктов делить на исходные вещества:
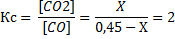
Ведь Кс=2. Дальше решаем уравнение любым способом (лучше всего через PhotoMath). Х не является ответом! Ответ – концентрация СО, а она равна 0,45-Х!