Термометрия
Термометрия или термический анализ основан на измерении температуры фазовых переходов (плавления, кристаллизации, кипения) веществ и их смесей. При нагревании или охлаждении вещества
| его температура меняется непрерывно, но в момент фазового перехода в некотором интервале наступает постоянство температур, связанное с поглощением или выделением теплоты при изменении фазового состояния (Рис.5.1). Постоянная температура остается стабильной до завершения фазового перехода и только после этого начинает изменяться дальше. Температуры фазовых переходов являются константами веществ и используются для определения их идентичности. | 
|
| Рис.5.1 Изменения температуры в момент фазового перехода |
Температуру плавления (Т плав) определяют обычно капиллярным методом, когда сухим веществом набивают запаянный с одной стороны капилляр длиной не более 10 мм; помещают капилляр в специальный прибор, где он нагревается; Т плав считается момент начала изменения вещества – плавления, побурения, вспенивания. Точными температурами плавления обладают только абсолютно чистые вещества.
Температура затвердевания (Т затв) определяется в приборе, состоящем из пробирки, в которую помещают вещество, термометр и мешалку. Весь прибор помещают в стакан с охлаждающей смесью (холодная вода, смесь льда с солью). При понижении температуры отмечают момент образования твердой фазы.
| Температуру кипения (Т кип) обычно определяют методом перегонки: собирают установку для перегонки (Рис.5.2), вносят в перегонную колбу 50 мл вещества, помещают туда несколько капилляров для предотвращения бурного вскипания и нагревают до начала кипения. Термометр при этом фиксирует температуру паров вещества. Для большей точности отсчет Т кип начинают после отгонки 10–15% вещества (отгонка возможных примесей), завершают измерение после отгонки 85–90% вещества. | 
|
| Рис.5.2 Прибор для определения температуры кипения |
Определение идентичности веществ осуществляют измерением температурных констант фазовых переходов смешанных проб вещества и образца. Многие вещества, имея одинаковые или близкие температуры фазовых переходов (Т ф.п.), отличаются по своему строению. При Т ф.п., фазовые равновесия изменятся: Т плав смеси понизится, а Т кип повысится. Если при смешении образца и вещества Т ф.п. не изменяется, вещества считаются идентичными. Изменение температуры фазового перехода. свидетельствует о не идентичности веществ. На этом же принципе основано обнаружение примесей в веществах, поскольку в присутствии примесей Т плав и Т кип значительно изменяются.
Термический анализ позволяет определять молекулярная массу веществ либо по понижению температуры плавления основы (криоскопия), либо по повышению ее температуры кипения (эбулиоскопия). Известно, что Т плав системы понижается, а Т кип повышается пропорционально содержанию постороннего вещества:
| М = К · m в-ва·1000/ m р-теляΔ T затв, | (5.5) |
| М = Е · m в-ва·1000/ m р-теляΔ T кип, | (5.5) |
где К – криоскопическая константа; Е – эбуллиоскопическая константа.
Описанный вариант метода термогравиметрии, когда изучают отклонение от линейности зависимости температуры от времени, отличается невысокой чувствительностью. Для ее повышения использу-
| ют дифференциальный способ регистрации разности температур между анализируемым веществом и веществом сравнения (дифференциальный термический анализ). В этом случае на термограмме наблюдаются четко выраженные максимумы (при экзотермических процессах) либо минимумы (при эндотермических процессах) (Рис.5.3). | 
|
| Рис.5.3 Кривая дифференциального термического анализа |
Современные приборы дериватографы позволяют комбинировать все варианты термических измерений и регистрировать все измеряемые величины на самописце при изменении температуры.
Термогравиметрия
Термогравиметрия основана на измерении изменений массы вещества при его нагревании, сопровождающемся его высушиванием, разложением. Эти процессы могут идти в несколько стадий. Например, при высушивании сначала удаляется свободная, затем – более прочно связанная влага; при дальнейшем нагревании проходят процессы пиролиза вещества. Каждый из указанных процессов проходит при достижении для данного вещества одной постоянной температуры и сопровождается потерей массы. Ход термогравиметрической кривой представлен на Рис.5.4.
| Такие измерения проводятся с помощью специальных термовесов. Анализ позволяет определять составные части веществ и примеси в них: термические характеристики примесей отличаются от характеристик вещества и на термогравиграмме появляются соответствующие изменения, качественно и количественно связанные со свойствами примеси. | 
|
| Рис.5.4 Термогравиметрическая кривая |
Калориметрия
Калориметрия или энтальпиметрия основана на измерении теплот химических реакций. В момент фазовых переходов или химических превращений вещество поглощает или выделяет определенное количество теплоты, что регистрируется чувствительными термоэлементами, помещенными в образец. Нагревают одновременно исследуемый образец и стандартное вещество, измеряя либо разность тепловых потоков между ними (дифференциальная сканирующая калориметрия), либо разность температур нагреваемого образца и стандарта, устойчивого при нагревании (дифференциальный термический анализ).
С помощью калориметрического анализа определяют калорийность пищевых продуктов – теплоту сгорания вещества. Для этого используется специальный прибор калориметрическая бомба или бомбовый калориметр – прочный герметически закрывающийся сосуд, окруженный теплоизолирующей водной рубашкой (Рис.5.5). Образец продукта известной массы помещается внутрь бомбы и сжигается при помощи электрической искры в атмосфере чистого кислорода под давлением 25 атм. Энергия, выделяющаяся в результате горения продукта, передается водяной рубашке, что приводит к повышению ее температуры. Зная изменение температуры в камере и природу исследуемого вещества (т.е. его теплоемкость), можно рассчитать тепловой эффект реакции сгорания вещества по формуле:
| Q = [ C камеры + (m · c содержим)]Δ T. | (5.6) |

|
| Рис.5.5 Калориметрическая бомба |
Термометрическое титрование
Термометрическое титрование основано на определении точки эквивалентности по результатам изменения температуры титруемой смеси. Это универсальный метод, не требующий индикаторов. Проводят титрование, измеряя температуру титруемой смеси. При титровании между титрантом и определяемым веществом происходит химическая реакция, сопровождающаяся поглощением или выделением теплоты. В момент эквивалентности реакции температурные изменения в системе заканчиваются. Поэтому, поместив в титруемую смесь чувствительный датчик температуры, можно зафиксировать момент эквивалентности по прекращению изменений температуры системы. Кривая термометрического титрования представлена на Рис.5.6.
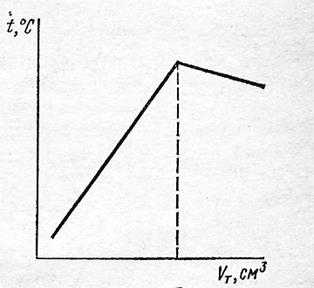
|
| Рис.5.6 Кривая термометрического титрования |
Контрольные вопросы
1. В чем сущность термического метода анализа?
2. Дайте определения понятиям «тепловой эффект реакции», «энтальпия реакции».
3. Что называется фазовым переходом вещества? Какую информацию о веществе дает измерение температур его фазовых переходов?
4. Дайте классификацию термическим методам анализа, опишите кратко их сущность.
5. Какие приборы применяют для проведения термического анализа? Какие параметры измеряют с помощью дериватографов?
6. В чем преимущество термических методов анализа по сравнению с другими физико-химическими методами?
7. Опишите методы измерения температуры кипения, плавления и затвердевания вещества. Как определяют наличие примесей в веществе по изменению температур фазовых переходов?
8. Как определяют молекулярную массу вещества методами криоскопии и эбуллиоскопии?
9. Что означает понятие «калорийность пищевого продукта»? Как измеряют калорийность продуктов с помощью термического анализа? Опишите устройство калориметрической бомбы.
10. Приведите кривую термометрического титрования. Как с помощью данной кривой определяют концентрацию анализируемого вещества?