Углеводороды
Углеводороды – это органические вещества, состоящие из атомов углерода и водорода.
| АЛКАНЫ (насыщенные или предельные) | АЛКЕНЫ(ненасыщенные или непредельные) | АЛКИНЫ (ненасыщенные или непредельные) | |
| Строение молекулы | Все связи одинарные | Одна двойная связь, остальные одинарные | Одна тройная связь, остальные одинарные |
| Общая формула | СnH2n+2, где n≥1 | СnH2n, где n≥2 | СnH2n-2, где n≥2 |
| Примеры | СН4 – метан С2Н6 – этан С3Н8 – пропан С4Н10 – бутан и т.д. | С2Н4 – этен (этилен) С3Н6 – пропен (пропилен) С4Н8 – бутен и т.д. | С2Н4 – этин (ацетилен) С3Н4 – пропин С4Н6 – бутин и т.д. |
| Угол между связями | 109о28′ | 120о | 180о |
| Получение | Al4C3 + 12H2O => карбид алюминия 3CH4 + 4Al(OH)3 метан | to, kat СН3-СН3 => СН2=СН2 + Н2 этан этилен to, H2SO4 С2Н5ОН => СН2=СН2 + Н2О этанол этилен | to, kat СН2=СН2 => СН≡СН + Н2 этилен ацетилен СаС2 + 2Н2О => карбид кальция Са(ОН)2 + СН≡СН ацетилен 1500оС 2СH4 => CH≡CH + 3H2 метан ацетилен |
| Характерные реакции | Замещения, отщепления | Присоединения | Присоединения |
Алканы.

Между любыми двумя связями в молекулах алканов угол равен 109о28′.
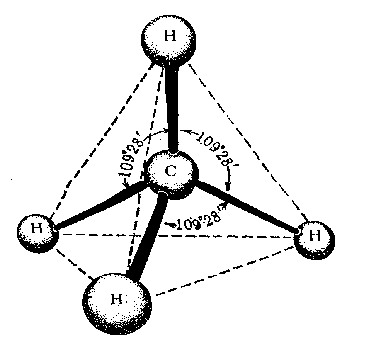
Физические свойства алканов
С ростом числа атомов углерода в гомологическом ряду алканов возрастают:
· температуры кипения;
· температуры плавления;
· плотность.
Алканы с количеством углерода 1-4 (метан, этан, пропан, бутан) представляют собой бесцветные газы, не имеющие запаха, 5-14 — бесцветные жидкости с характерным запахом, >15 — твёрдые легкоплавкие вещества без запаха.
Все алканы практически не растворяются в воде.
Для алкенов и алкинов аналогично.
Химические свойства алканов.
1) Реакции замещения.
Алканы реагируют при освещении (hν) с галогенами (хлором, бромом). При этом постепенно происходит замещение атомов водорода в молекуле алкана на атомы галогена
hν
СН4 + Cl2 => CH3Cl + HCl
метан хлорметан
2) Реакции дегидрирования (отщепление водорода).
При нагревании в присутствии катализатора все алканы способны разлагаться с отщеплением водорода:
t,кат
СH3-CH3 => CH2=CH2 + H2
этан этен
Метан при температуре 1500оС разлагается на ацетилен и водород:
1500оС
2СH4 => CH≡CH + 3H2
метан ацетилен
Нахождение в природе и применение алканов
Газообразные алканы (метан — бутан) входят в состав природного газа. Жидкие и твёрдые алканы содержатся в нефти.
Применяются в качестве топлива, для получения других органических веществ.
Непредельные углеводороды (алкены, алкины).
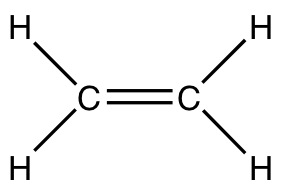
В молекуле этилена (этена) валентный угол равен 120о
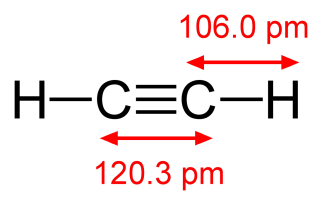
В молекуле ацетилена (этина) валентный угол равен 180о
Химические свойства.
Непредельным углеводородам характерны реакции присоединения. Вторые и третьи связи непрочные, поэтому могут легко разрываться. По обрывкам связи присоединяются какие-либо атомы.
а) Гидрирование (присоединение водорода):
kat
СН≡СН + Н2 => СН2=СН2
ацетилен этилен
kat
СН2=СН2 + Н2 => СН3-СН3
этилен этан
б) Галогенирование (присоединение галогенов) – качественная реакция на двойную и тройную связь. Для реакции берется раствор брома в воде, который называется бромной водой (жёлтого цвета). Признак реакции – обесцвечивание бромной воды.
СН2=СН2 + Br2 => СН2Br-СН2Br
этилен (жёлт) 1,2-дибромэтан
(бесцветный)
СН≡СН + 2Br2 => СНBr2-СНBr2
ацетилен 1,1,2,2-тетрабромэтан
в) Гидратация (присоединение воды)
Н+
СН2=СН2 + Н2О => С2Н5ОН
этилен этанол
Н+, Нg2+
СН≡СН + Н2О => СН3-СНО
ацетилен уксусный альдегид
Реакциигорения.
Реакции горения (окисления кислородом) характерны для всех органических веществ. При этом образуются углекислый газ и вода
СН4 + 2О2 = СО2↑ + 2Н2О
С2Н4 + 3О2 = 2СО2↑ + 2Н2О
2С2Н2 + 5О2 = 4СО2↑ + 2Н2О и т.д.