Задание
Конспект «Альдегиды и кетоны». По этой теме будет практическая работа
Альдегиды и кетоны
Цель: изучить строение, способы получения, физические и химические свойства альдегидов и кетонов, их применение.
План лекции
1. Строение альдегидов и кетонов
2. Физические свойства
3. Способы получения
4. Химические свойства
5. Применение
Альдегидами называются соединения, в которых карбонильная группа соединена с углеводородным радикалом и атомом водорода, а кетонами – карбонильные соединения с двумя углеводородными радикалами.

Систематические названия альдегидов строят по названию соответствующего углеводорода с добавлением суффикса - аль.
Нумерацию цепи начинают с карбонильного атома углерода. Тривиальные названия производят от тривиальных названий тех кислот, в которые альдегиды превращаются при окислении:
H2C=O –метаналь (муравьиный альдегид, формальдегид);
CH3CH=O – этаналь (уксусный альдегид).
Систематические названия кетонов несложного строения производят от названий радикалов с добавлением слова кетон. В более общем случае название кетона строится по названию соответствующего углеводорода и суффикса -он; нумерацию цепи начинают от конца цепи, ближайшего к карбонильной группе. Примеры:
CH3–CO–CH3 - диметилкетон (пропанон, ацетон);
CH3CH2CH2–CO–CH3 - метилпропилкетон (пентанон-2).
Для альдегидов и кетонов характерна структурная изомерия.
Изомерия альдегидов:
а) изомерия углеродного скелета, начиная с С4;
б)межклассовая изомерия.
Изомерия кетонов:
а) углеродного скелета (c C5);
б)положения карбонильной группы (c C5);
в) межклассовая изомерия.
Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp2 -гибридизации. Связь С=О сильно полярна. Электроны кратной связи С=О смещены к электроотрицательному атому кислорода, что приводит к появлению на нём частичного отрицательного заряда, а карбонильный атом углерода приобретает частичный положительный заряд.
Физические свойства
Все низшие алифатические альдегиды и кетоны представляют собой бесцветные легкоподвижные жидкости (исключение формальдегид - газ). Температуры кипения ихзначительно ниже, чем соответствующих спиртов (так как молекулы не ассоциированы, нет подвижных водородов). Альдегиды и кетоны хорошо растворяются во всех органических растворителях. Формальдегид, уксусный альдегид, ацетон смешиваются с водой. Все они легче воды, горючи и ядовиты. Низшие альдегиды и кетоны имеют сильный и резкий запах. Ароматические альдегиды и кетоны, наоборот являются высококипящими жидкостями или твёрдыми веществами. Эти альдегиды мало токсичны, являются душистыми веществами. Они встречаются в природе и используются в парфюмерии, имея запах горького миндаля (бензальдегид), корицы (коричный альдегид), ванили (ванилин). Ароматическое ядро сильно уменьшает их растворимость в воде.
Способы получения
1. С2H5ОН + CuO → CH3CHO + Cu + H2O (окисление первичных спиртов)
2. а) СH3CH2CHCl2 + 2NaOH 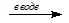 CH3CH2CHO + 2NaCl + H2O (гидролиз)
CH3CH2CHO + 2NaCl + H2O (гидролиз)
б) СH3ССl2CH3 + 2NaOH 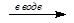 СH3COCH3 + 2NaCl + H2O из дигалогенопроизводных)
СH3COCH3 + 2NaCl + H2O из дигалогенопроизводных)
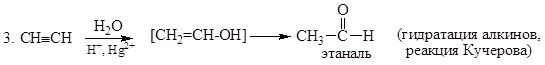
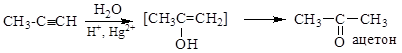
4. CH2=CH2 + [O] ®CH3-CH=O (PdCl2, Cu2Cl2 100о С, 1МПа) (окисление этилена до этаналя)
CH4 + O2 ® H2C=O + H2O (400-600о С, NO) (окисление метана до формальдегида)
Химические свойства
Для альдегидов и кетонов характерны реакции различных типов: восстановление и окисление.
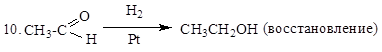
2. R-CH=O + Ag2O  R-COOH + 2Ag¯ (окисление, реакция "серебряного зеркала")
R-COOH + 2Ag¯ (окисление, реакция "серебряного зеркала")
R-CH=O + 2Cu(OH)2 ® R-COOH + Cu2O¯ + 2H2O (красный осадок, окисление)
Применение альдегидов и кетонов
Формальдегид (метаналь, муравьиный альдегид) H2C=O:
а) для получения фенолформальдегидных смол;
б) получение мочевино-формальдегидных (карбамидных) смол;
в) полиоксиметиленовые полимеры;
г) синтез лекарственных средств (уротропин);
д) дезинфицирующее средство;
е) консервант биологических препаратов (благодаря способности свёртывать белок).
Уксусный альдегид (этаналь, ацетальдегид) СН3СН=О:
а) производство уксусной кислоты;
б) органический синтез.
Ацетон СН3-СО-СН3:
а) растворитель лаков, красок, ацетатов целлюлозы;
б) сырьё для синтеза различных органических веществ.