Восьмое ноября
Попробуем объяснить некоторые удивительные факты:
· Почему растворы кислот, солей и щелочей проводят электрический ток.
· Почему температура кипения раствора электролита всегда будет выше, чем температура кипения раствора не электролита той же концентрации.
В 1887 году шведский физико- химикСванте Аррениус, исследуя электропроводность водных растворов, высказал предположение, что в таких растворах вещества распадаются на заряженные частицы – ионы, которые могут передвигаться к электродам – отрицательно заряженному катоду и положительно заряженному аноду.
Это и есть причина электрического тока в растворах. Данный процесс получил название электролитической диссоциации (дословный перевод – расщепление, разложение под действием электричества). Такое название также предполагает, что диссоциация происходит под действием электрического тока. Дальнейшие исследования показали, что это не так: ионы являются только переносчиками зарядов в растворе и существуют в нем независимо от того, проходит через раствор ток или нет. При активном участии Сванте Аррениуса была сформулирована теория электролитической диссоциации, которою часто называют в честь этого ученого. Основная идея данной теории заключается в том, что электролиты под действием растворителя самопроизвольно распадаются на ионы. И именно эти ионы являются носителями заряда и отвечают за электропроводность раствора.
Электрический ток - это направленное движение свободных заряженных частиц. Вы уже знаете, что растворы и расплавы солей и щелочей электропроводны, так как состоят не из нейтральных молекул, а из заряженных частиц – ионов. При расплавлении или растворении ионы становятся свободными переносчиками электрического заряда.
Процесс распада вещества на свободные ионы при его растворении или расплавлении называют электролитической диссоциацией.
Сущность процесса электролитической диссоциации солей
Сущность электролитической диссоциации заключается в том, что ионы становятся свободными под влиянием молекулы воды (рис. 1). Процесс распада электролита на ионы отображают с помощью химического уравнения. Запишем уравнение диссоциации хлорида натрия и бромида кальция. При диссоциации одного моля хлорида натрия образуются один моль катионов натрия и один моль хлорид-анионов.
NaCl⇄Na+ + Cl-
При диссоциации одного моля бромида кальция образуется один моль катионов кальция и два моля бромид-анионов.
CaBr2⇄Ca2+ + 2Br-
Обратите внимание: так как в левой части уравнения записана формула электронейтральной частицы, то суммарный заряд ионов должен быть равен нулю.
Вывод: при диссоциации солей образуются катионы металла и анионы кислотного остатка.
Сущность процесса электролитической диссоциации щелочей
Рассмотрим процесс электролитической диссоциации щелочей. Запишем уравнение диссоциации в растворе гидроксида калия и гидроксида бария.
При диссоциации одного моля гидроксида калия образуются один моль катионов калия и один моль гидроксид-анионов.
KOH⇄K+ + OH-
При диссоциации одного моля гидроксида бария образуются один моль катионов бария и два моля гидроксид-анионов.
Ba(OH)2⇄Ba2+ + 2 OH-
Вывод: при электролитической диссоциации щелочей образуются катионы металла и гидроксид-анионы.
Нерастворимые в воде основания практически не подвергаются электролитической диссоциации, так как в воде они практически нерастворимы, а при нагревании – разлагаются, так что расплав их получить не удается.
Сущность процесса электролитической диссоциации кислот
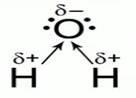
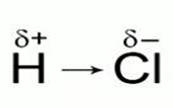
Рис. 1. Строение молекул хлороводорода и воды
Рассмотри процесс электролитической диссоциации кислот. Молекулы кислот образованы ковалентной полярной связью, а значит, кислоты состоят не из ионов, а из молекул.
Возникает вопрос – как же тогда кислота диссоциирует, т. е. как в кислотах образуются свободные заряженные частицы? Оказывается, ионы образуются в растворах кислот именно при растворении.
Рассмотрим процесс электролитической диссоциации хлороводорода в воде, но для этого запишем строение молекул хлороводорода и воды (рис. 1).
Обе молекулы образованы ковалентной полярной связью. Электронная плотность в молекуле хлороводорода смещена к атому хлора, а в молекуле воды – к атому кислорода. Молекула воды способна оторвать катион водорода от молекулы хлороводорода, при этом образуется катион гидроксония Н3О+.
В уравнении реакции электролитической диссоциации не всегда учитывают образование катиона гидроксония – обычно говорят, что образуется катион водорода.
Тогда уравнение диссоциации хлороводорода выглядит так:
HCl⇄H+ + Cl-
При диссоциации одного моля хлороводорода образуются один моль катиона водорода и один моль хлорид-анионов.
Ступенчатая диссоциация кислот