Фосфор — элемент 3-го периода и VA-группы Периодической системы, порядковый номер 15. Электронная формула атома [10Ne]3s23p3, устойчивая степень окисления в соединениях +V.
Шкала степеней окисления фосфора:

Электроотрицательность фосфора (2,32) значительно ниже, чем у типичных неметаллов, и немного выше, чем у водорода. Образует различные кислородсодержащие кислоты, соли и бинарные соединения, проявляет неметаллические (кислотные) свойства. Большинство фосфатов нерастворимы в воде.
В природе — тринадцатый по химической распространенности элемент (шестой среди неметаллов), встречается только в химически связанном виде. Жизненно важный элемент.
Недостаток фосфора в почве восполняется введением фосфорных удобрений — главным образом суперфосфатов. Аллотропные модификации фосфора

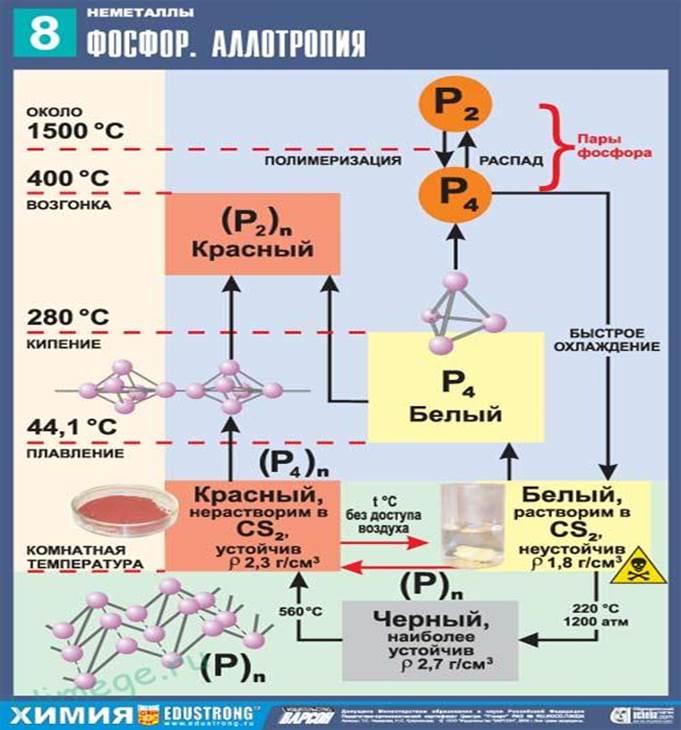
Красный и белый фосфор Р. Известно несколько аллотропных форм фосфора в свободном виде, главные — это белый фосфор Р4 и красный фосфор Pn. В уравнениях реакций аллотропные формы представляют как Р (красн.) и Р (бел.).
Красный фосфор состоит из полимерных молекул Pn разной длины. Аморфный, при комнатной температуре медленно переходит в белый фосфор. При нагревании до 416 °С возгоняется (при охлаждении пара конденсируется белый фосфор). Нерастворим в органических растворителях. Химическая активность ниже, чем у белого фосфора. На воздухе загорается только при нагревании.
Применяется как реагент (более безопасный, чем белый фосфор) в неорганическом синтезе, наполнитель ламп накаливания, компонент намазки коробка при изготовлении спичек. Не ядовит.
Белый фосфор состоит из молекул Р4. Мягкий как воск (режется ножом). Плавится и кипит без разложения (tпл 44,14 °С, tкип 287,3 °С, р 1,82 г/см3). Окисляется на воздухе (зеленое свечение в темноте), при большой массе возможно самовоспламенение. В особых условиях переводится в красный фосфор. Хорошо растворим в бензоле, эфирах, сероуглероде. Не реагирует с водой, хранится под слоем воды. Чрезвычайно химически активен. Проявляет окислительно-восстановительные свойства. Восстанавливает благородные металлы из растворов их солей.
Применяется в производстве Н3Р04 и красного фосфора, как реагент в органических синтезах, раскислитель сплавов, зажигательное средство. Горящий фосфор следует гасить песком (но не водой!). Чрезвычайно ядовит.
Уравнения важнейших реакций фосфора: 
Получение в промышленности фосфора
— восстановление фосфорита раскаленным коксом (песок добавляют для связывания кальция):
Ca3(PО4)2 + 5С + 3SiО2 = 3CaSiO3 + 2 Р + 5СО (1000 °С)
Пар фосфора охлаждают и получают твердый белый фосфор.
Красный фосфор готовят из белого фосфора (см. выше), в зависимости от условий степень полимеризации n (Pn) может быть различной.
Соединения фосфора
Фосфин РН3. Бинарное соединение, степень окисления фосфора равна — III. Бесцветный газ с неприятным запахом. Молекула имеет строение незавершенного тетраэдра [: Р(Н)3] (sр3-гибридизация). Мало растворим в воде, не реагирует с ней (в отличие от NH3). Сильный восстановитель, сгорает на воздухе, окисляется в HNО3 (конц.). Присоединяет HI. Применяется для синтеза фосфорорганических соединений. Сильно ядовит.
Уравнения важнейших реакций фосфина:

Получение фосфина в лаборатории:
СазP2 + 6НСl (разб.) = ЗСаСl + 2 РНз
Оксид фосфора (V) P2O5. Кислотный оксид. Белый, термически устойчивый. В твердом и газообразном состояниях димер Р4О10 со строением из четырех тетраэдров [O=Р(O)3], связанных по трем вершинам (Р — О-P). При очень высоких температурах мономеризуется до P2O5. Существует также стеклообразный полимер (Р205)п. Чрезвычайно гигроскопичен, энергично реагирует с водой, щелочами. Восстанавливается белым фосфором. Отнимает воду у кислородсодержащих кислот.
Применяется как весьма эффективный дегидратирующий агент для осушения твердых веществ, жидкостей и газовых смесей, реагент в производстве фосфатных стекол, катализатор полимеризации алкенов. Ядовит.
Уравнения важнейших реакций оксида фосфора +5:

Получение: сжигание фосфора в избытке сухого воздуха.
Ортофосфорная кислота Н3Р04. Оксокислота. Белое вещество, гигроскопичное, конечный продукт взаимодействия P2O5 с водой. Молекула имеет строение искаженного тетраэдра [Р(O)(OН)3] (sр3-гибридизадия), содержит ковалентные σ-связи Р — ОН и σ, π-связь Р=O. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворяется в воде (548 г/100 г Н20). Слабая кислота в растворе, нейтрализуется щелочами, не полностью — гидратом аммиака. Реагирует с типичными металлами. Вступает в реакции ионного обмена.
Качественная реакция — выпадение желтого осадка ортофосфата серебра (I). Применяется в производстве минеральных удобрений, для осветления сахарозы, как катализатор в органическом синтезе, компонент антикоррозионных покрытий на чугуне и стали.
Уравнения важнейших реакций ортофосфорной кислоты:

Получение фосфорной кислоты в промышленности:
кипячение фосфоритной руды в серной кислоте:
Ca3(PO4)2 + 3H2SO4 (конц.) = 2 Н3РО4 + 3CaSO4
Ортофосфат натрия Na3PO4. Оксосоль. Белый, гигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. Реагируется в растворе с цинком и алюминием.
Вступает в реакции ионного обмена.
Качественная реакция на ион РО43-
— образование желтого осадка ортофосфата серебра(I).
Применяется для устранения «постоянной» жесткости пресной воды, как компонент моющих средств и фотопроявителей, реагент в синтезе каучука. Уравнения важнейших реакций:

Получение: полная нейтрализация Н3Р04 гидроксидом натрия или по реакции:

Гидроортофосфат натрия Na2HPO4. Кислая оксосоль. Белый, при умеренном нагревании разлагается без плавления. Хорошо растворим в воде, гидролизуется по аниону. Реагирует с Н3Р04 (конц.), нейтрализуется щелочами. Вступает в реакции ионного обмена.
Качественная реакция на ион НРО42- — образование желтого осадка ортофосфата серебра (I).
Применяется как эмульгатор при сгущении коровьего молока, компонент пищевых пастеризаторов и фотоотбеливателей.
Уравнения важнейших реакций:

Получение: неполная нейтрализация Н3Р04 гидроксидом натрия в разбавленном растворе:
2NaOH + Н3РО4 = Na2HPO4 + 2H2O
Дигидроортофосфат натрия NaH2PO4. Кислая оксосоль. Белый, гигроскопичный. При умеренном нагревании разлагается без плавления. Хорошо растворим в воде, анион Н2Р04 подвергается обратимой диссоциации. Нейтрализуется щелочами. Вступает в реакции ионного обмена.
Качественная реакция на ион Н2Р04 — образование желтого осадка ортофосфата серебра(1).
Применяется в производстве стекла, для защиты стали и чугуна от коррозии, как умягчитель воды.
Уравнения важнейших реакций:

Получение: неполная нейтрализация H3PО4 едким натром:
Н3РО4 (конц.) + NaOH (разб.) = NaH2PO4 + H2O
Ортофосфат кальция Са3(PO4)2 — Оксосоль. Белый, тугоплавкий, термически устойчивый. Нерастворим в воде. Разлагается концентрированными кислотами. Восстанавливается коксом при сплавлении. Основной компонент фосфоритных руд (апатиты и др.).
Применяется для получения фосфора, в производстве фосфорных удобрений (суперфосфаты), керамики и стекла, осажденный порошок — как компонент зубных паст и стабилизатор полимеров.
Уравнения важнейших реакций:

Фосфорные удобрения
Смесь Са(Н2Р04)2 и CaS04 называется простым суперфосфатом, Са(Н2Р04)2 с примесью СаНР04 — двойным суперфосфатом, они легко усваиваются растениями при подкормке.
Наиболее ценные удобрения — аммофосы (содержат азот и фосфор), представляют собой смесь аммонийных кислых солей NH4H2PO4 и (NH4)2HPO4.
Хлорид фосфора (V) PCI5. Бинарное соединение. Белый, летучий, термически неустойчивый. Молекула имеет строение тригональной бипирамиды (sp3 d-гибридизация). В твердом состоянии димер P2Cl10 с ионным строением РСl4+[РСl6]—. «Дымит» во влажном воздухе. Весьма реакционноспособный, полностью гидролизуется водой, реагирует со щелочами. Восстанавливается белым фосфором. Применяется как хлорагент в органическом синтезе. Ядовит. Уравнения важнейших реакций:

Получение: хлорирование фосфора.