Сера - химически активный неметалл. Известны ее соединения почти со всеми элементами, кроме инертных газов, золота и платиновых металлов.
При взаимодействии с простыми веществами, образованными элементами с меньшей ЭО, сера проявляет окислительные свойства: S0 + 2ё → S2-
При взаимодействии с простыми веществами, образованными элементами с большей ЭО, сера проявляет восстановительные свойства:

Так, сера горит на воздухе голубоватым пламенем, при этом образуется диоксид серы:
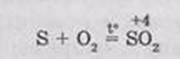
Сероводород
Сероводород H2S — бесцветный, сильно ядовитый газ с неприятным запахом; Тпл.=-85 °С и Ткип = -60 °С. Растворимость H2S в воде невелика (при комнатной температуре в одном объеме воды растворяется 2,5 объема H2S).
В природе сероводород образуется в больших количествах за счет биохимических процессов.
Бактерии, производящие H2S являются самыми древними организмами на Земле. Сероводород содержится также в вулканических газах и в водах минеральных источников.
В промышленности и в лаборатории сероводород получают действием сильных кислот на сульфиды металлов.
Будучи двухосновной, сероводородная кислота образует два ряда солей — сульфиды и гидросульфиды. В отличие от большинства сульфидов, гидросульфиды хорошо растворяются в воде.
Сульфиды и, в меньшей степени гидросульфиды в водных растворах подвергаются гидролизу, так как они образованы слабой кислотой. Например:

 ся в оксиды, иногда в сульфаты, а иногда выделяют свободный металл.
ся в оксиды, иногда в сульфаты, а иногда выделяют свободный металл.
Некоторые сульфиды имеют переменный состав. По
лисульфиды, например, железо (II) образует несколько
сульфидов, из которых наиболее важны FeS (сульфид
железа) и FeS2 (дисульфид железа). Объясняется это тем,
что атомы серы в составе сульфидов могут образовывать
между собой ковалентные связи (так называемые «сульфидные мостики»). Графическая формула FeS2 выглядит следующим образом:
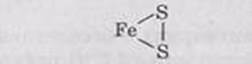
Для натрия известны полисульфиды переменного состава от Na2S2 до Na2S5. Если к желтому раствору полисульфида приливать соляную кислоту, происходит полное разложение многосернистых металлов с образованием H2S и S.
Оксиды серы
Сера с кислородом образует несколько оксидов, но устойчивыми являются только два: SO2 — оксид серы (IV) и SO3 — оксид серы (VI). В свойствах этих соединений имеются и сходство, и различие.
Как оксиды типичного неметалла, они оба имеют кислотный характер, более выраженный у SO3. Но разная степень окисления атома серы в SO2 и SO3 обусловливает существенное различие в окислительно-восстановительных свойствах этих соединений.
Кислотные свойства
Проявляя химические свойства типичных кислотных оксидов, сернистый и серный ангидрид взаимодействуют:
а) с основаниями, образуя два типа солей: кислые и средние.
SO2 + NaOH → NaHSO3 гидросульфит натрия
SO3 + NaOH → NaHSO4 гидросульфат натрия
б) с основными оксидами
SO2 + CaO → CaSO3 сульфит кальция
SO3 + CaO → CaSO4 сульфат кальция
в) с водой
SO2 + H2O → H2SO3
SO3 + H2O → H2SO4