В одном из прошлых уроков мы изучили первый закон термодинамики. Он гласит, что количество теплоты, переданное системе равно сумме изменения внутренней энергии системы и работы, совершенной системой. Мы рассмотрим тот случай, когда система представляет собой идеальный газ и применим первый закон термодинамики к различным процессам.
В первую очередь, вспомним газовые законы и соответствующие им процессы, которые мы тоже не так давно изучали. Закон Бойля-Мариотта описывает изотермический процесс, при котором температура газа не меняется:
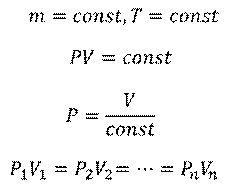
В этом случае, произведение давления и объёма газа остается величиной постоянной.
Закон Гей-Люссака описывает изобарный процесс, при котором давление газа постоянно:

В этом случае, отношение объёма к температуре остается постоянной величиной.
Также существует закон Шарля, описывающий изохорный процесс, при котором объём газа не меняется:

В этом случае, отношение давления к температуре остается величиной постоянной.
Итак, применим ко всем этим трем процессам первый закон термодинамики. Если температура газа постоянна, значит, его внутренняя энергия тоже постоянна, то есть изменение внутренней энергии равно нулю:
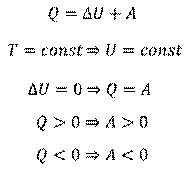
Таким образом, при изотермическом процессе все количество теплоты, которое получает газ, идет на совершение работы. Нетрудно догадаться, что если газ получает тепло, то он совершает положительную работу. И наоборот, - если газ отдает тепло окружающей среде, то он совершает отрицательную работу.
При изохорном процессе объём остается неизменным. Это значит, что работа газа равна нулю:

Следовательно, все количество теплоты, получаемое газом, идет на изменение внутренней энергии. Опять же, легко заметить, что если газ нагревается, то внутренняя энергия увеличивается. И наоборот, — если газ охлаждается, то внутренняя энергия уменьшается.
Рассмотрим теперь изобарный процесс, то есть процесс, происходящий при постоянном давлении. Напомним, что в этом случае, работа газа равна произведению давления и изменения объёма:
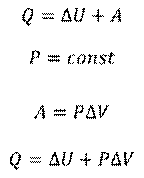
Таким образом, уравнение, описывающее первый закон термодинамики, принимает несколько иную форму при постоянном давлении.
Кроме этих трех процессов, существует ещё один процесс, заслуживающий внимания. Этот процесс называется адиабатным. Данный процесс происходит при отсутствии теплообмена между системой и окружающими телами. Таким образом, при адиабатном процессе, газ совершает работу за счет изменения внутренней энергии:

То есть внутренняя энергия газа будет уменьшаться, если газ будет совершать положительную работу. И наоборот, внутренняя энергия газа будет увеличиваться, если внешние силы совершают работу над газом.
Рассмотрим теперь изолированную систему тел. Как мы помним, в изолированной системе работа равна нулю и внутренняя энергия всей системы остается постоянной. При этом внутренняя энергия какого-то тела, входящего в систему, может увеличиваться, а может и уменьшаться. Но суммарное изменение внутренней энергии будет равно нулю:

Это приводит нас к выводу, что суммарное количество теплоты, полученное системой равно нулю:
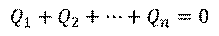
То есть некоторые тела системы получили ровно столько тепла, сколько отдали другие тела системы. Уравнение, описывающее это явление, называется уравнением теплового баланса.
В уравнении теплового баланса количества теплоты выражаются через известные нам формулы, в зависимости от того, какой процесс происходит. Например, у нас есть формулы, соответствующие плавлению или кристаллизации, есть формулы, соответствующие парообразованию или конденсации и так далее.
Пример решения задачи.
Задача. Адиабатно расширяясь, водяной пар совершил работу, равную 11 кДж. Масса пара составляет 0,5 кг. Если начальная температура пара 390 К, то какова его конечная температура?
