Тема. Азотсодержащие гетероциклические соединения.
Пятичленные и шестичленные гетероциклические соединения.
Гетероциклические соединения — это органические соединения, содержащие в своих молекулах кольца (циклы), в образовании которых кроме атома углерода принимают участие и атомы других элементов.
Атомы других элементов, входящие в состав гетероцикла, называются гетероатомами. Наиболее часто встречаются в составе гетероциклов гетероатомы азота, кислорода, серы, хотя могут существовать гетероциклические соединения с самыми различными элементами, имеющими валентность не менее двух.
Гетероциклические соединения могут иметь в цикле 3, 4, 5, 6 и более атомов. Однако наибольшее значение имеют пяти- и шестичленные гетероциклы. Эти циклы, как и в ряду карбоциклических соединений, образуются наиболее легко и отличаются наибольшей прочностью. В гетероцикле может содержаться один, два и более гетероатомов.
Во многих гетероциклических соединениях электронное строение связей в кольце такое же, как и в ароматических соединениях. Поэтому типичные гетероциклические соединения условно обозначают не только формулами, содержащими чередующиеся двойные и одинарные связи, но и формулами, в которых сопряжение p-электронов обозначается кружком, вписанным в формулу.
В состав циклических молекул многих органических веществ, кроме атомов углерода, входят также атомы азота, серы, кислорода и некоторых других элементов.
Такие вещества относят к гетероциклическим.
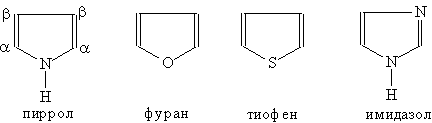
Пятичленные гетероциклы
Шестичленные гетероциклы
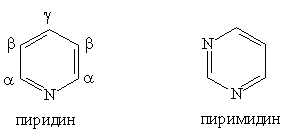
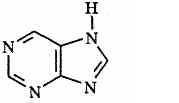
Большое значение имеют гетероциклы, конденсированные с бензольным кольцом или с другим гетероциклом, например пурин:
|
|
Пиридин
Нуклеиновые кислоты.
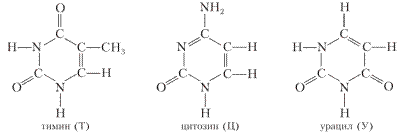
Производные пиримидина и пурина — азотистые основания тимин, цитозин, урацил, аденин и гуанин:
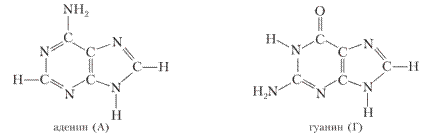
Азотистые основания входят в состав важнейших биополимеров — нуклеиновых кислот.
Хранителями наследственной информации у всех форм жизни служат полимерные молекулы нуклеиновых кислот — ДНК (дезоксирибонуклеиновая кислота) или РНК (рибонуклеиновая кислота). В молекулах нуклеиновых кислот информация о строении организма, т. е. всех его белков, записана в виде последовательности мономеров — нуклеотидов.
Каждый мономер нуклеиновых кислот — нуклеотид — состоит из соединённых остатков:
• азотистого основания;
• моносахарида (рибозы или дезоксирибозы);
• фосфорной кислоты.
РАССМОТРИМ ПРОИЗВОДНЫЕ ПИРИМИДИНА — УРАЦИЛ, ЦИТОЗИН, ТИМИН.
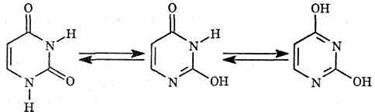
Урацил (У) — в зависимости от условий может существовать в разных формах:
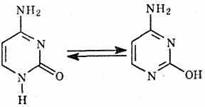
Цитозин (Ц):
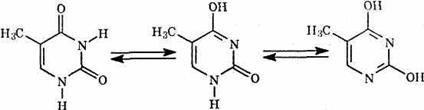
Тимин (Т):
Пиримидиновое кольцо вместе с кольцом имидазола образуют бициклическое основание — пурин:
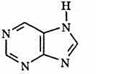
Наиболее широко из производных пурина в природе распространены аденин и гуанин.
Аденин (А), представляет собой кристаллическое вещество, плавящееся с разложением при 360°С, труднорастворимое в воде:
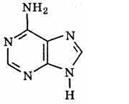
В свободном состоянии он содержится в растительных и животных тканях.
Гуанин (Г), содержится в растительных и животных тканях. В воде и спирте гуанин почти не растворим, но легко растворяется в кислотах и щелочах с образованием солей:
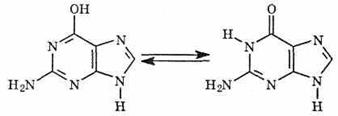
Производные пиримидина — урацил, тимин, цитозин — и производные пурина — аденин и гуанин — называются пиримидиновыми и пуриновыми основаниями соответственно. Пиримидиновые и пуриновые основания входят в состав нуклеиновых кислот.
|
|
Понятие об азотсодержащих гетероциклических соединениях
Большое биологическое значение имеют азотсодержащие гетероциклические соединения. Это, например, пиррол — соединение с пятичленным кольцом:
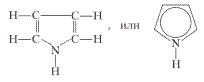
Пиридин — соединение с шестичленным кольцом:
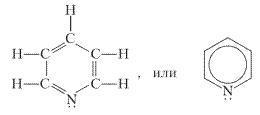
Ядро пиридина содержится в молекулах витамина РР, предупреждающего развитие пеллагры (заболевания кожи), и витамина B6. За счёт неподелённой электронной пары у атома азота пиридин обладает основными свойствами.
Основные свойства характерны также для таких азотсодержащих гетероциклических соединений, как пиримидин и пурин:
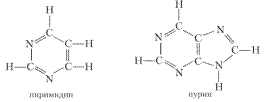
Особенности некоторых гетероциклических соединений:
Пиридин
1) это шестичленное гетероциклическое соединение с одним гетероатомом азота в цикле:
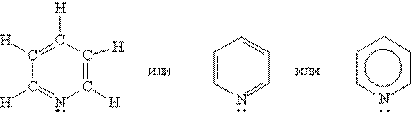
2) это бесцветная жидкость с неприятным запахом, хорошо растворимая в воде;
3) пиридин и его гомологи содержатся в каменноугольной смоле, которая и служит источником их получения;
4) на основании структурной формулы можно высказать двоякое суждение о свойствах пиридина;
5) наличие двойных связей в молекуле указывает на его высокую реакционноспособность, а сходство по строению с бензолом позволяет предположить, что вещество обладает большой химической способностью;
6) пиридин также имеет и много общего с бензолом по строению и свойствам.
В молекуле бензола каждый атом углерода, находясь в состоянии sр2-гибридизации, три электрона затрачивает на образование δ-связей и один электрон – на образование общего для молекулы π-облака (при боковом перекрывании облаков шести р -электронов). В молекуле пиридина одну группу СН заменяет атом азота, и он «поставляет» два электрона на установление δ-связей с двумя соседними углеродными атомами и один электрон – в систему π-облака, при этом, как и в молекуле бензола, образуется устойчивый секстет электронов. У атома азота остается после этого еще пара свободных электронов;
|
|
7) пиридин, как и бензол, устойчив по отношению к окислителям: он не обесцвечивает раствор перманганата калия даже при нагревании;
8) пиридин нитруется, реакция идет в более жестких условиях, чем у бензола, образуется нитропиридин:
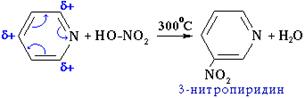
Гетероциклическое соединение пиридин – это азотистое основание ароматического характера.
Применение пиридина:
1) ароматические и основные свойства пиридина используются при синтезе разного рода лекарственных препаратов, красителей, гербицидов;
2) также пиридин используется как растворитель для денатурирования этанола;
3) Ядро пиридина содержится в молекулах витамина РР, предупреждающего развитие пеллагры – заболевания кожи.
Пиррол
Пятичленный гетероцикл с одним атомом азота.
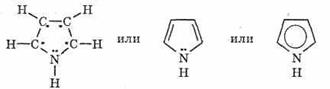
При рассмотрении электронного строения молекулы пиррола видно, что электронная пара пиррольного азота участвует в образовании шестиэлектронной структуры, поэтому этот азот практически не обладает основными свойствами.
Пиррол — жидкость без цвета, tкип=130°С. Пиррол на воздухе окисляется и при этом темнеет.