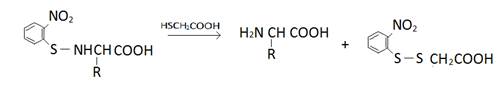
Химический синтез пептидов и белков.
Пептидный синтез – это построение пептидной цепи химическими методами. Обычно 40-45 аминокислот.
Методы синтеза пептидных связей многообразны и различны в зависимости от поставленной задачи. Если требуются белковоподобные соединения с беспорядочным расположением аминокислот в цепи, или гомополипептиды то пригодны одностадийные способы поликонденсации, аналогичные классическим методом химии синтетических полимеров.
Для получения белков с заданной первичной структурой основная схема синтеза включает следующие стадии:
1. Получение карбоксильного компонента пептидного синтеза путем защиты аминогруппы данной аминокислоты или пептида.
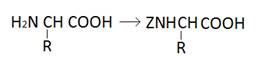
2. Синтез аминокомпонента путем защиты карбоксильной группы другой аминокислоты или пептида
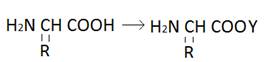
3. Активация карбоксильной группы аминокомпонента или аминогруппы карбоксикомпонента.
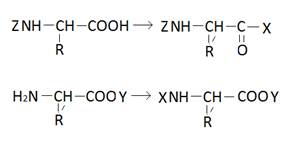
4. Конденсация
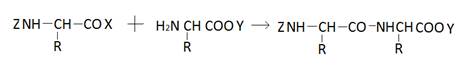
или
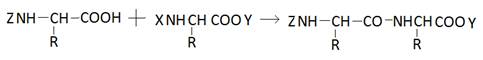
5. Удаление защитных групп. Оно может проводиться в одну стадию, если синтез на этом заканчивается.
Если предполагается дальнейшее удлинения цепи, то удаляется только одна защитная группа и так далее.
В зависимости от используемых методических приемов и характера синтезируемого продукта различают следующие типы пептидного синтеза:
1. Синтез в растворе подразделяется на а) ступенчатый синтез линейных пептидов от C-конца до N-концу и б) блочный синтез линейных пептидов когда построение цепи ведется из предварительно синтезируемых фрагментов.
2. Синтез на полимерном носителе: растущая полипептидная цепь ковалентно присоединена к неразветвленному или раствортмому полимеру. Отделение осуществляться на завершающей стадии. Твердофазный вариант существует в настоящее время в полностью автоматизированном варианте. Приборы называют синтезаторами.
3. Синтез из гомо - и гетерополиаминокислот, построенных из повторяющихся остатков одной или двух аминокислот путем полимеризации или сополимеризации производных аминокислот (N-карбоксиангидридов и т.д.)
4. Ферментативный полипептидной синтез. Существенного результата пока не удалось получить.
5. Полусинтез пептида. Использование методов пептидного синтеза для модификации природных пептидов. Отщепление небольшого фрагмента, а затем введение новой аминокислотной последовательности.
6. Синтез циклических пептидов - замыкание линейного в цикл соответствующей величины различными способами.
7. Синтез гетерогенных пептидов - как амид. связи там и сложноэфирные, тиоэфирные, дисульфидные.
Защитные группы используемые в пептидном синтезе
Постоянные (снимаются на заключительном этапе синтеза)
Временные - снимаемые перед каждой стадией удлинения цепи или конденсацией фрагмента.
Должны удовлетворять следующим условиям:
1. Полностью блокировать защитную группу от участия в химической реакции;
2. Быть устойчивыми в ходе удаления другой защитной группы;
3. Не вызать побочных реакций и рацемизации при введении, удалении или образовании пептидной связи;
4. Защищеные производные должны быть устойчивыми и идентифицируемыми соединениями.
5. Не вызывать осложнений с растворимостью и выделением пептидов из реакционной смеси.
Защита аминогруппы
1. Наиболее удобен - образование соединений типа уретанов

Например: карбоксигруппа легко вводится в аминокислоту или пептид при помощи карбобензоксихлорида, который получают взаимодействием бензилового спирта и фосгена
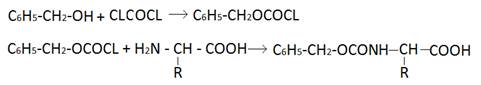
Может быть удалена различным способом: HBr/CH3COOH, Na в жидком NH3, H2/kat.безводной CF3COOH, триэтилсилана.
Это разнообразие позволяет подобрать остальные защитные группировки так, чтобы в условиях удаления карбоксибензокосигруппы они сохранялись.
При восстановительном удалении образуется углекислый газ и толуол, которые легко отделить в ходе синтеза.
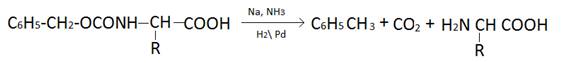
Среди уритановых группировок интерес представляют устойчивые к кислотному гидролизу, но удаляемые мягким щелочным гидролизом 9-флуоренилметилоксикарбонильная Fmoc. Удаляется морфолином или пиперидином в диметилформамиде.
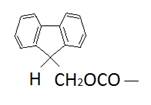
Метиосульфонилэтилоксикарбонильная Msc
СH3SO2CH2O-CO- (NaOH, Ph 10-12, 0C)
Fmoc - группа широко применяется, в частности, твердофазном синтезе пептидов.
Защитные группы ацильного типа не используются в качестве временных защит, групп и т.к. не удаляются без расщепления пептидных связей. Фармильная и трифторацетильная группы используются для защиты N-групп лизина.
Фталильную и тозильную используют редко из-за жесткости условиях их удаления(гидразин или Na в жидком NH3.)
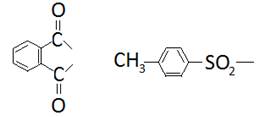
Phb Tos
Защитные группы алкильного (арильного) типа также используется сравнительно редко. Исключение: 0-нитрофенилсульфенильная
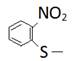
Легко вводятся с помощью соответствующего хлорида, а удаляется с помощью ацитолиза или тиолиза (тиоцитомид или тиогликолевая кислота)