ЛАБОРАТОРНАЯ РАБОТА №4
Цель работы: определить удельную теплоемкость вещества.
Оборудование:
1) испытуемое тело;
2) калориметр;
3) внешний стакан от калориметра;
4) весы технические;
5) разновес;
6) термометр с ценой деления  С;
С;
7) муфты с крючками;
8) штатив универсальный;
9) лабораторная электроплитка.
краткие ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ.
За единицу количества теплоты принимается то количество теплоты, которое необходимо, чтобы нагреть 1г воды на  С, например: от 19 до
С, например: от 19 до  С. Эта единица количества теплоты называется малой калорией.
С. Эта единица количества теплоты называется малой калорией.
Количество теплоты, приобретаемое телом при нагревании или теряемое при охлаждении, пропорционально его массе и разности температур в конце и начале опыта, т.е.:  ,
,
где Q – количество теплоты в калориях, m – масса тела в граммах, с – коэффициент пропорциональности,  – конечная температура,
– конечная температура,  – начальная температура.
– начальная температура.
Для определения коэффициента пропорциональности с возьмем частный случай: пусть m =1г, 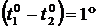 C, тогда
C, тогда  , т.е. с – теплота в калориях, необходимая для одного грамма тела на
, т.е. с – теплота в калориях, необходимая для одного грамма тела на  С.
С.
Количество теплоты Q, необходимое для нагревания 1 грамма вещества на  С, называется удельной теплоемкостью вещества с.
С, называется удельной теплоемкостью вещества с.
Теплоемкость любого тела может быть выражена произведением удельной теплоемкости на величину его массы (в граммах). Для жидких и твердых тел определяют теплоемкость при постоянном давлении, в то время как для газов определяется ее теплоемкость при постоянном объеме. Величина теплоемкости изменяется с изменением температуры.
Для определения удельной теплоемкости пользуются методом смещения. Этот метод заключается в том, что два тела, нагретые до различных температур, при этом столько теплоты потеряет нагретое тело, сколько приобретет более холодное. Это справедливо, если тепло больше никуда уходить не будет.
Пусть мы имеем M граммов твердого тела с удельной теплоемкостью тела
с, нагретого до  С. Поместим это тело в калориметр с водой. Пусть масса воды
С. Поместим это тело в калориметр с водой. Пусть масса воды  грамм, теплоемкость воды –
грамм, теплоемкость воды –  , температура ее –
, температура ее –  С, масса калориметра –
С, масса калориметра –  , теплоемкость –
, теплоемкость –  .
.
Количество теплоты, потерянное более нагретым телом будет равна:
 .
.
Количество теплоты, приобретенное водой, равно 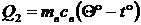 .
.
Количество теплоты, приобретенное калориметром, равно  .
.
Тогда  (теплоемкость калориметра
(теплоемкость калориметра  смотри в справочнике). Из формулы легко определить неизвестную теплоемкость с:
смотри в справочнике). Из формулы легко определить неизвестную теплоемкость с:
 .
.
При более точном определение теплоемкости необходимо учесть теплоту, ушедшую на нагревание термометра и на лучеиспускание во внешнюю среду.
Чтобы избавиться от введения поправок на потерю тепла во внешнюю среду, ученый Румфорд рекомендует брать первоначальную температуру воды на столько градусов ниже комнатной, на сколько приблизительно она будет выше после смешения.
Ход работы.
1) Найти массу испытуемого тела M с точностью до 20г.
2) Поместить его в калориметрический обогреватель, подвешивая на нити, подогревать тело при  С не менее 20 минут.
С не менее 20 минут.
3) Пока происходит нагревание тела, определить массу  – внутреннего стакана калориметра.
– внутреннего стакана калориметра.
4) Налить в калориметр столько воды, чтобы испытуемое тело полностью погрузилось в воду, и опять взвесить калориметр с водой.
5) Перед опусканием испытуемого тело в калориметр измерить температуру воды в калориметре  С, а затем быстро вынуть тело из обогревателя, погрузить в калориметр, помешивая воду.
С, а затем быстро вынуть тело из обогревателя, погрузить в калориметр, помешивая воду.
От присутствия горячего тела температура воды в калориметре начинает повышаться. Температуру следует измерять, когда прекратится дальнейшее повышение температуры и начнется медленное охлаждение.
Наивысшую температуру измерить термометром перед началом охлаждения, выписать и принять за общую  . Температуру тела считают равной температуре
. Температуру тела считают равной температуре  кипящей воды при атмосферном давлении. Удельную температуру калориметра взять из справочника.
кипящей воды при атмосферном давлении. Удельную температуру калориметра взять из справочника.
6) С каждым телом произвести по три измерения. Искомая удельная теплоемкость будет равна:  .
.
Следует отметить, что калория как единица измерения количества теплоты в настоящее время представляет только исторический интерес, несмотря на удобство использования.
По новой программе теплота в школьном курсе измеряется в джоулях (Дж).
7) Произвести оценку погрешности результата по методике прямых измерений.
КОНТРОЛЬНЫЕ ВОПРОСЫ.
1. Закон Дюлонга и Пти.
2. Уравнение теплового баланса.
Литература
1. Кикоин А.К., Кикоин И.К. Молекулярная физика. (137, 138)