ХИМИЯ
Сборник индивидуальных домашних заданий
для студентов технических направлений
дневной формы обучения
НОВОСИБИРСК
2012
УДК
Составители: А.И. Апарнев, к.х.н., доцент
В.К. Варенцов, д.т.н., профессор
Г.К. Лупенко, к.х.н., доцент
Р.Е. Синчурина, ассистент
Рецензенты: Т.П. Александрова, к.х.н., доцент
Работа подготовлена на кафедре химии
Ó Новосибирский государственный
ОГЛАВЛЕНИЕ
Тема 1. Химический эквивалент. Закон эквивалентов. Окислительно-восстановительные реакции.......................................................................................................... 5
Тема 2. Строение вещества....................................................... 7
Тема 3. Основные закономерности протекания химических процессов 8
Тема 4. Кинетика химических процессов и химическое равновесие 9
Тема 5. Растворы электролитов............................................. 12
Тема 6. Коллоидные растворы................................................ 16
Тема 7. Общие свойства растворов....................................... 19
Тема 8. Комплексные соединения.......................... 21
Тема 9. Электрохимические процессы.......................... 23
Приложения................................................................................. 30
Литература................................................................................. 40
ПРЕДИСЛОВИЕ
Выполнение индивидуальных заданий дает возможность проверить уровень усвоения основных разделов курса химии. Индивидуальная работа осуществляется в основном по учебникам Коровин Н. В. Общая химия: учебник для вузов / В. Н. Коровин. – М.: Высшая школа, 2008; Глинка Н. Л. Общая химия: [учебное пособие для вузов] / Н. Л. Глинка; под ред. А. И. Ермакова. – М.: Интеграл-Пресс, 2005 и конспектам лекций. Необходимые справочные данные приведены в приложении. Студенту выдается определенное число заданий по темам, номер варианта соответствует номеру в журнале группы. Задания выполняются в письменной форме в отдельной тетради (или на отдельных листах) и сдаются преподавателю в сроки, указанные в учебном плане.
Т е м а 1
Химический эквивалент.
Закон эквивалентов.
Окислительно-восстановительные реакции
Задание 1. Даны массы двухвалентного металла (m Ме), его оксида (m о) и сульфида (m с) (см. ваш вариант в табл. 1).
Рассчитайте молярные массы эквивалентов металла, серы, оксида и сульфида металла. Установите и запишите химические формулы веществ.
Задание 2. Даны масса двухвалентного металла (m Ме) и объем кислорода ( ), затраченного на его окисление при н.у. (см. ваш вариант в табл. 1).
), затраченного на его окисление при н.у. (см. ваш вариант в табл. 1).
Рассчитайте молярную массу эквивалентов металла, молярную массу металла и назовите металл.
Т а б л и ц а 1
| Номер варианта | Задание 1 | Задание 2 | Номер варианта | Задание 1 | Задание 2 | ||||||
| m Ме, г | m о, г | m с, г | m Ме, г |  ,
л ,
л
| m Ме, г | m о, г | m с, г | m Ме, г |  ,
л ,
л
| ||
| 3,01 | 3,56 | 4,11 | 17,9 | 1,46 | 3,74 | 4,99 | 6,24 | 7,42 | 1,41 | ||
| 3,22 | 4,01 | 4,80 | 9,4 | 1,61 | 3,66 | 6,07 | 8,48 | 5,05 | 0,89 | ||
| 2,58 | 3,23 | 3,88 | 6,6 | 3,04 | 2,98 | 4,17 | 5,36 | 5,44 | 1,52 | ||
| 3,07 | 3,95 | 4,83 | 7,9 | 1,01 | 3,22 | 3,93 | 4,64 | 16,56 | 1,65 | ||
| 4,07 | 5,18 | 6,29 | 9,8 | 1,87 | 3,99 | 4,59 | 5,19 | 4,4 | 5,47 | ||
| 3,88 | 5,01 | 6,14 | 11,4 | 2,01 | 3,65 | 4,29 | 4,93 | 3,3 | 1,52 | ||
| 2,98 | 3,21 | 3,44 | 6,6 | 3,04 | 3,72 | 4,25 | 4,78 | 10,36 | 0,56 | ||
| 3,34 | 3,79 | 4,24 | 5,8 | 1,62 | 3,94 | 4,66 | 5,38 | 4,98 | 0,95 | ||
| 2,74 | 3,13 | 3,52 | 11,4 | 0,93 | 2,86 | 3,56 | 4,26 | 21,85 | 1,22 | ||
| 2,51 | 2,71 | 2,91 | 4,9 | 0,84 | 4,41 | 5,52 | 6,63 | 10,64 | 1,12 | ||
| 3,17 | 3,43 | 3,69 | 10,84 | 1,08 | 2,27 | 2,92 | 3,57 | 8,18 | 3,77 | ||
| 3,35 | 3,74 | 4,13 | 15,8 | 2,02 | 2,31 | 2,94 | 3,57 | 15,88 | 2,03 | ||
| 4,59 | 5,28 | 5,97 | 9,15 | 1,47 | 2,14 | 2,66 | 3,19 | 7,3 | 2,04 |
Задание 3. Дана схема реакции (см. в табл. 2):
1. определите степень окисления атомов элементов, меняющих ее в процессе реакции;
2. составьте электронный баланс с учетом принципа равенства числа отдаваемых и принимаемых электронов, укажите процессы окисления и восстановления;
3. запишите множители в уравнение окислительно - восстановительной реакции как основные стехиометрические коэффициенты;
4. подберите стехиометрические коэффициенты остальных участников реакции;
5. выпишите формулы вещества – окислителя и восстановителя и рассчитайте их молярные массы эквивалентов.
Т а б л и ц а 2
| Номер варианта | Схема реакции |
| KI + KIO3 + H2SO4 ® I2 + K2SO4 + H2O | |
| SnCl2 + K2Cr2O7 + HCl ® SnCl4 + CrCl3 + KCl + H2O | |
| CuS + HNO3 ® Cu(NO3)2 + NO2 + H2SO4 + H2O | |
| KMnO4 + HCl ® MnCl2 + Cl2 + KCl + H2O | |
| HNO2 + KMnO4 + H2SO4 ® HNO3 + MnSO4 + K2SO4 + H2O | |
| K2Cr2O7 + HBr ® CrBr3 + Br2 + KBr + H2O | |
| H2S + Cl2 + H2O ® H2SO4 + HCl | |
| I2 + HNO3 ® HIO5 + NO + H2O | |
| HNO3 + Zn ® Zn(NO3)2 + N2O + H2O | |
| FeS + HNO3 ® Fe(NO3)2 + S + NO + H2O | |
| Cr2O3 + KClO3 + KOH ® K2CrO4 + KCl + H2O | |
| K2Cr2O7 + KI + H2SO4 ® Cr2(SO4)3 + I2 + K2SO4 + H2O | |
| FeCl2 + HNO3 + HCl ® FeCl3 + NO + H2O | |
| H2SO3 + HNO3 ® H2SO4 + NO + H2O | |
| K2Cr2O7 + SO2 + HCl ® CrCl3 + KCl + H2SO4 + H2O | |
| Cl2 + Br2 + KOH ® KCl + KBrO3 + H2O | |
| K2Cr2O7 + H2O2 + H2SO4 ® O2 + Cr2(SO4)3 + H2O + K2SO4 | |
| NaIO3 + CO + H2SO4 ® I2 + CO2 + Na2SO4 + H2O | |
| H2S + HClO3 ® H2SO4 + HCl |
О к о н ч а н и е т а б л. 2
| KCl + KMnO4 + H2SO4 ®Cl2 + MnSO4 + K2SO4 + H2O | |
| FeSO4 + KClO3 + H2SO4 ® Fe2(SO4)3 + KCl + H2O | |
| Cr2(SO4)3 + Br2 + NaOH®Na2CrO4 + NaBr + Na2SO4 + H2O | |
| MnSO4 + KMnO4 + H2O ® MnO2 + H2SO4 + K2SO4 | |
| Sn + HNO3 ® Sn(NO3)2 + N2 + H2O | |
| Ca + HNO3 ® Ca(NO3)2 + NH4NO3 + H2O |
Т е м а 2.
Строение вещества
Задание. Для элементов, атомы которых образуют молекулу (см. вариант в табл. 3):
1. напишите электронные формулы, подчеркните валентные электроны и определите семейство;
2. укажите значения квантовых чисел для валентных электронов;
3. распределите валентные электроны по энергетическим ячейкам и определите валентность в основном (невозбужденном) и возбужденном состояниях;
4. объясните связь электронного строения атома элементов с их положением в периодической системе (период, группа, подгруппа);
Т а б л и ц а 3
| Номер варианта | Формула вещества | Номер варианта | Формула вещества | Номер варианта | Формула вещества |
| CF4 | AlCl3 | BrF3 | |||
| CCl4 | GaCl3 | BeCl2 | |||
| NF3 | SBr6 | CS2 | |||
| SiCl4 | SiBr4 | SnCl2 | |||
| PI3 | SbBr3 | ScBr3 | |||
| AsCl3 | HgCl2 | AsF5 | |||
| PCl3 | PCl5 | CdF2 | |||
| SeF4 | SF6 | SCl6 | |||
| PbCl2 | InI3 | BF3 |
5. определите степени окисления элементов в молекуле;
6. составьте электронные формулы для атомов элементов с данной степенью окисления и охарактеризуйте их окислительно-восстановительные свойства;
7. охарактеризуйте химические свойства элементов, заполнив таблицу:
| Элемент | Формула оксида | Формула гидроксида | Формула водородного соединения |
| Химический характер |
Т е м а 3
Основные закономерности протекания
химических процессов
Задание. Дано уравнение реакции (см. вариант в табл. 4).
1. Для всех веществ, участвующих в реакции, выпишите из приложения 1 значения стандартных термодинамических величин  и
и  .
.
2. Вычислите изменение энтальпии реакции  и определите, является ли данная реакция экзо- или эндотермической. Запишите термохимическое уравнение реакции.
и определите, является ли данная реакция экзо- или эндотермической. Запишите термохимическое уравнение реакции.
3. По виду уравнения реакции, не прибегая к расчетам, определите знак изменения энтропии реакции  . Вычислив изменение энтропии реакции в стандартных условиях, объясните знак
. Вычислив изменение энтропии реакции в стандартных условиях, объясните знак  .
.
4. Вычислите энергию Гиббса прямой реакции в стандартных условиях  и установите возможность самопроизвольного протекания реакции.
и установите возможность самопроизвольного протекания реакции.
5. Определите температуру, при которой реакция находится в равновесии (Тр).
6. Рассчитайте  при Т 1 = Т р–100, Т 2 = Т р+100.
при Т 1 = Т р–100, Т 2 = Т р+100.
7. Постройте график зависимости  от Т и обозначьте на графике область температур самопроизвольного протекания реакции.
от Т и обозначьте на графике область температур самопроизвольного протекания реакции.
8. Вычислите значения константы равновесия Кc при температурах Т р, Т 1 и Т 2. Cделайте вывод о влиянии температуры на величину Кc и на смещение химического равновесия.
Т е м а 4
Кинетика химических процессов
и химическое равновесие
Задание 1. Дано уравнение реакции (см. вариант в табл. 4).
1. Запишите кинетические уравнения скоростей прямой  и обратной
и обратной  реакций. Гомо- или гетерогенной является данная реакция?
реакций. Гомо- или гетерогенной является данная реакция?
2. Рассчитайте скорость прямой реакции  в начальный момент времени (при Со). Как изменится скорость прямой реакции к моменту времени
в начальный момент времени (при Со). Как изменится скорость прямой реакции к моменту времени 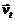 , когда прореагирует 20 % вещества В?
, когда прореагирует 20 % вещества В?
3. Рассчитайте увеличение скорости прямой реакции  при одновременном повышении давления в системе в 2 раза и температуры
при одновременном повышении давления в системе в 2 раза и температуры 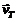 на 20 °С при g = 2.
на 20 °С при g = 2.
Задание 2. Даны уравнение реакции и исходные концентрации веществ (см. вариант табл. 4).
1. Запишите выражение для константы равновесия химической реакции через концентрации К с.
2. Рассчитайте равновесные концентрации всех веществ к моменту времени, когда прореагирует 30 % вещества А и вычислите константу равновесия.
3. Укажите направление смещения равновесия при изменении каждого из факторов (С, Р, V и Т).
Т а б л и ц а 4
| Номер варианта | Задание 1, 2 | Изменение внешних условий | |||||
| аА + bВ ó cC + dD | Cо (А), моль/л | Cо (В), моль/л | С исх | Р | V | Т | |
| CН4(г) + Н2О(г) = CO(г) + 3 Н2(г) | ↑ | ↓ | ↓ | ↓ | |||
| СS2(г) + 4 Н2(г) = CH4(г) + 2 Н2S(г) | 0,2 | 0,8 | ↑ | ↑ | ↑ | ↓ | |
| CO2(г) + 2 H2(г) = C(т) + 2 Н2О(г) | 0,8 | 1,5 | ↓ | ↓ | ↑ | ↑ | |
| 2 NF3(г) + O2(г) = 2 NOF3(г) | ↑ | ↑ | ↓ | ↓ | |||
| СО2(г) + 4 Н2 = СН4(г) + 2 Н2О(г) | 0,5 | ↑ | ↑ | ↓ | ↓ | ||
| 2 PCl5(г) + О2 = 2 POCl3(г) + 2 Сl2(г) | 0,3 | 1,5 | ↓ | ↓ | ↑ | ↑ | |
| 2 AsCl3(г) + 3 H2(г) = 2 As(г) + 6 НCl(г) | 0,2 | 0,6 | ↑ | ↑ | ↓ | ↓ | |
| 2 СН3ОН(г) + 3 О2 = 2 СО2(г) + 4 Н2О(г) | ↓ | ↓ | ↑ | ↑ | |||
| 2 NO2(г) + F2(г) = 2 (NO2)F(г) | ↓ | ↓ | ↑ | ↑ | |||
| О2(г) + 2 Н2S(г) = 2 S(т) + 2 Н2О(г) | ↑ | ↑ | ↓ | ↓ | |||
| 2 PF3(г) + О2(г) = 2 POF3(г) | ↓ | ↓ | ↑ | ↑ | |||
| S2(г) + 4 CO2(г) = 2 SO2(г) + 4 CO(г) | ↑ | ↑ | ↓ | ↓ |
О к о н ч а н и е т а б л. 4
| Номер варианта | Задание 1, 2 | Изменение внешних условий | |||||
| аА + bВ ó cC + dD | Cо (А), моль/л | Cо (В), моль/л | С исх | Р | V | Т | |
| 2 NO(г) + 2 SO2(г) = N2(г) + 2 SO3(г) | 0,2 | 0,4 | ↑ | ↑ | ↑ | ↑ | |
| 2 CO(г) + 2 H2 = CH4(г) + CО2(г) | ↓ | ↓ | ↑ | ↑ | |||
| 2 H2S(г) + SO2(г) = 3 S(т) + 2 H2O(г) | ↓ | ↓ | ↓ | ↓ | |||
| 2 PCl3(г) + O2(г) = 2 PCl3O(г) | ↑ | ↑ | ↑ | ↑ | |||
| SiCl4(г) + 2 Н2(г) = Si(т) + 4 HCl(г) | ↓ | ↓ | ↓ | ↓ | |||
| 2 NO(г) + Cl2(г) = 2 NOCl(г) | ↑ | ↑ | ↑ | ↓ | |||
| SО2(г) + 2 Н2S(г) = 3 S(т) + 2 H2O(ж) | ↓ | ↑ | ↑ | ↓ | |||
| CCl4(г) + 2 Н2(г) ó CН4(г) + 2 Cl2(г) | ↑ | ↓ | ↑ | ↑ | |||
| 2 H2О (г) + 2 Cl2(г) = 4 НCl (г) + O2(г) | ↑ | ↓ | ↓ | ↑ | |||
| 2 BCl3(г) + 3 Н2(г) = 2 В(т) + 6 HCl(г) | ↓ | ↑ | ↓ | ↑ | |||
| CS2(г) + 2 Сl2(г) = CCl4(г) + 2 S(т) | ↑ | ↓ | ↑ | ↑ | |||
| 2 H2S(г) + 3 О2 = 2 Н2О(г) + 2 SO2(г) | 0,3 | 0,9 | ↑ | ↑ | ↓ | ↑ | |
| 2 NO(г) + 2 H2(г) = N2(г) + 2 H2O(г) | ↓ | ↑ | ↑ | ↓ |
Т е м а 5
Растворы электролитов
Задание 1. Имеется раствор вещества данной концентрации и плотности (см. вариант в табл. 5).
Определите молярную концентрацию вещества (С), молярную концентрацию эквивалентов вещества (С эк), массовую долю растворенного вещества (ω, %) в растворе и титр раствора (Т).
Таблица 5
| Номер варианта | Вещество | ρ, г/мл | Концентрация | ||
| С эк, моль/л | ω, % | С, моль/л | |||
| AlCl3 | 1,016 | ||||
| AgNO3 | 1,194 | 1,4 | |||
| CaСl2 | 1,032 | ||||
| Cu(NO3)2 | 1,036 | 0,22 | |||
| Fe2(SO4)3 | 1,181 | ||||
| MnCl2 | 1,068 | ||||
| Zn(NO3)2 | 1,067 | 0,9 | |||
| NiSO4 | 1,21 | 2,8 | |||
| ZnSO4 | 1,084 | 1,3 | |||
| H2SO4 | 1,038 | ||||
| (NH4)2SO4 | 1,115 | ||||
| Al2(SO4)3 | 1,105 | 1,3 | |||
| Na2CO3 | 1,05 | ||||
| K2SO4 | 1,056 | ||||
| H3PO4 | 1,150 | 3,0 | |||
| Co(NO3)2 | 1,015 | 0,11 | |||
| Mg(NO3)2 | 1,044 | ||||
| Na2SO4 | 1,053 | ||||
| Ba(NO3)2 | 1,015 | 0,5 |
Окончание табл. 5
| Номер варианта | Вещество | ρ, г/мл | Концентрация | ||
| С эк, моль/л | ω, % | С, моль/л | |||
| FeCl3 | 1,032 | ||||
| MnSO4 | 1,059 | ||||
| Na2CO3 | 1,013 | ||||
| ZnCl2 | 1,035 | 0,6 | |||
| MgSO4 | 1,27 | 2,54 | |||
| CoSO4 | 1,08 |
Задание 2. Сколько миллилитров раствора А с заданной массовой долей w (%) и плотностью r (г/мл) потребуется для нейтрализации раствора В, содержащего определенную массу т растворенного вещества (см. табл. 6)
Т а б л и ц а 6
| Номер варианта | Раствор А | Раствор В | |||
| Формула вещества | w, % | r, г/мл | Формула вещества | m, г | |
| H2SO4 | 1,025 | КОН | 1,4 | ||
| HCl | 1,36 | 1,005 | Ва(ОН)2 | 1,71 | |
| HNO3 | 1,02 | Са(ОН)2 | 0,74 | ||
| Н3РО4 | 1,031 | КОН | 0,7 | ||
| HCl | 1,008 | Sr(OH)2 | 0,61 | ||
| КОН | 1,3 | 1,01 | H2SO4 | 0,49 | |
| H2SO4 | 5,5 | 1,034 | NaOH | 0,4 | |
| NaOH | 4,2 | 1,045 | H2SO4 | 0,98 | |
| КОН | 8,9 | 1,079 | H2SO4 | 0,98 | |
| Н3РО4 | 1,031 | NaОН | 0,8 | ||
| КОН | 7,8 | 1,068 | Н3РО4 | 0,33 |
Окончание табл. 6
| Номер варианта | Раствор А | Раствор В | |||
| Формула вещества | w, % | r, г/мл | Формула вещества | m, г | |
| NaOH | 1,065 | Н3РО4 | 0,98 | ||
| NH4OH | 10,4 | 0,956 | H2SO4 | 1,47 | |
| NaOH | 1,12 | H2SO4 | 2,94 | ||
| Н3РО4 | 1,031 | NH4ОН | 0,7 | ||
| H2SO4 | 2,5 | 1,016 | NaОН | 0,4 | |
| Н3РО4 | 2,15 | 1,01 | NaОН | 0,2 | |
| HNO3 | 1,02 | Ba(OH)2 | 5,13 | ||
| Н3РО4 | 1,02 | LiОН | 4,8 | ||
| Н2SО4 | 2,5 | 1,016 | Ca(ОН)2 | 0,37 | |
| HCl | 4,4 | 1,02 | Sr(OH)2 | 0,61 | |
| H2SO4 | 1,025 | Ba(OH)2 | 0,71 | ||
| Н3РО4 | 1,02 | Ca(ОH)2 | 1,11 | ||
| H2SO4 | 5,5 | 1,034 | LiOH | 0,24 | |
| Н3РО4 | 1,02 | KОН | 1,68 |
Задание 3. Имеется раствор слабого электролита (см. вариант в табл. 7).
1. Запишите уравнения диссоциации и выражения для констант диссоциации (К д) по всем возможным ступеням, укажите их величины (см. приложение 2).
2. Рассчитайте степень диссоциации слабого электролита, концентрацию ионов H+ в растворе и рН данного раствора с заданной концентрацией электролита.
Задание 4. Имеется насыщенный раствор труднорастворимого электролита (см. вариант в табл. 7). Вычислите растворимость данного электролита (в моль/л и г/л) в одном литре воды, используя значение произведения растворимости (см. приложение 3).
Задание 5. Имеется раствор соли (см. вариант в табл. 7).
1. Напишите молекулярное и ионно-молекулярное уравнения реакции гидролиза и выражение для константы гидролиза по I ступени (К гI).
2. Рассчитайте степень гидролиза (a г) и рН раствора соли с заданной концентрацией, учитывая только 1-ую ступень гидролиза.
3. Какой цвет будет иметь индикатор метиловый оранжевый или фенолфталеин в растворе данной соли?
4. Как изменяться рН раствора соли и окраска индикатора при нагревании и почему?
Таблица 7
| Номер варианта | Задание 3 | Задание 4 | Задание 5 | ||
| Вещество | С, моль/л | Вещество | Вещество | С, моль/л | |
| HCN | 0,01 | Mg(OH)2 | CdSO4 | 0,02 | |
| НNO2 | 0,05 | Fe(OH)2 | Al(NO3)3 | 0,02 | |
| HOCl | 0,01 | Be(OH)2 | K2Se | 0,03 | |
| H2GeO3 | 0,02 | Bi(OH)3 | Ba(NO2)2 | 0,04 | |
| HF | 0,1 | Ga(OH)3 | CoCl2 | 0,05 | |
| HOBr | 0,05 | Cd(OH)2 | K2TeO4 | 0,02 | |
| HOI | 0,1 | Co(OH)2 | Na3BO3 | 0,01 | |
| Н2ТеО3 | 0,5 | Cr(OH)2 | Na2C2O4 | 0,02 | |
| H2С2O4 | 0,05 | Cu(OH)2 | FeCl2 | 0,05 | |
| H2SeO3 | 0,02 | Ni(OH)2 | FeBr3 | 0,01 | |
| Н2ТеО3 | 0,01 | Pb(OH)2 | NiSO4 | 0,05 | |
| HOCl | 0,05 | Sc(OH)3 | Na2Te | 0,01 | |
| H3BO3 | 0,01 | Mn(OH)2 | K2SiO3 | 0,01 | |
| H2S | 0,05 | Pd(OH)2 | MnSO4 | 0,02 | |
| H2Se | 0,02 | La(OH)3 | Na3AsO4 | 0,05 | |
| H2SO3 | 0,01 | Sn(OH)2 | K2GeO3 | 0,01 | |
| НNO2 | 0,02 | Fe(OH)2 | Cr(NO3)3 | 0,02 | |
| Номер варианта | Задание 3 | Задание 4 | Задание 5 | ||
| Вещество | С, моль/л | Вещество | Вещество | С, моль/л | |
| H2TeO4 | 0,01 | Mg(OH)2 | ZnBr2 | 0,05 | |
| HCN | 0,02 | Be(OH)2 | SnCl2 | 0,02 | |
| НNO2 | 0,1 | Bi(OH)3 | Na3PO3 | 0,01 | |
| H2SiO3 | 0,05 | Ga(OH)3 | K2TeO3 | 0,01 | |
| H2S | 0,02 | Sc(OH)3 | Na2SeO3 | 0,05 | |
| H2Se | 0,05 | Zn(OH)2 | CrCl2 | 0,02 | |
| H3AsO4 | 0,02 | Al(OH)3 | Pb(NO3)2 | 0,05 | |
| HCOOH | 0,01 | Со(OH)3 | Са3(VO4)2 | 0,01 |
Т е м а 6
Коллоидные растворы
Задание. Даны растворы двух реагентов (см. вариант в табл. 8).
- Напишите молекулярное уравнение химической реакции образования коллоидной частицы при смешивании двух растворов.
- Определите, какой реагент взят в избытке.
- Составьте формулу мицеллы, обозначьте и назовите ее составные части.
- Определите заряд коллоидной частицы и укажите, к какому электроду будут перемещаться частицы золя в постоянном электрическом поле.
- Какой из указанных электролитов будет обладать наилучшим коагулирующим действием. Объясните, почему?
Т а б л и ц а 8
| Номер варианта | Раствор I | Раствор II | Электролиты, вызывающие коагуляцию | ||||
| Вещество | С, моль/л | V, мл | Вещество | С, моль/л | V, мл | ||
| Sr(NO3)2 | 0,05 | Na2SO4 | 0,01 | KCl, ZnSO4, Na3PO4 | |||
| Pb(NO3)2 | 0,1 | KCl | 0,1 | K3PO4, CaCl2, Al2(SO4)3 | |||
| FeCl2 | 0,001 | Na2S | 0,002 | Na3PO4, Ca(NO3)2, Fe2(SO4)3 | |||
| BaCl2 | 0,01 | K3PO4 | 0,02 | Na3PO4, Ca(NO3)2, Fe2(SO4)3 | |||
| Na2CO3 | 0,5 | Ni(NO3)2 | 0,1 | K3PO4, CaCl2, Al2(SO4)3 | |||
| CdCl2 | 0,02 | KOH | 0,01 | K3PO4, CaCl2, Fe2(SO4)3 | |||
| Ni(NO3)2 | 0,02 | K2S | 0,02 | AlCl3, FeSO4, K3PO4 | |||
| Mg(NO3)2 | 0,5 | NaF | 0,1 | FeCl3, ZnSO4, Na3PO4 | |||
| AlCl3 | 0,01 | K3PO4 | 0,05 | ZnCl2, K3PO4, Fe2(SO4)3 | |||
| Ca(NO3)2 | 0,2 | K2CO3 | 0,1 | AlCl3, CuSO4, K3PO4 | |||
| SnCl2 | 0,05 | KOH | 0,01 | K3PO4, CaCl2, Al2(SO4)3 | |||
| ZnSO4 | 0,001 | K2SiO3 | 0,01 | Bi(NO3)3 , CuSO4, K3PO4 | |||
| Bi(NO3)3 | 0,02 | K2S | 0,002 | Na3PO4, ZnCl2, Al2(SO4)3 | |||
| MnCl2 | 0,05 | NaOH | 0,05 | K3PO4, CaCl2, Al2(SO4)3 | |||
| (NH4)2SO4 | 0,05 | AgNO3 | 0,01 | KI, Na3PO4, Al2(SO4)3 |
О к о н ч а н и е т а б л. 8
| Номер варианта | Раствор I | Раствор II | Электролиты, вызывающие коагуляцию | ||||
| Вещество | Сэк, моль/л | V, мл | Вещество | Сэк, моль/л | V, мл | ||
| CuSO4 | 0,02 | K2S | 0,01 | CaBr2, K3PO4, Al2(SO4)3 | |||
| Hg(NO3)2 | 0,005 | K3PO4 | 0,05 | NiSO4, K3PO4, Al(NO3)3 | |||
| CoCl2 | 0,05 | K2S | 0,1 | K3PO4, Na2HPO4 , ZnSO4 | |||
| Fe(NO3)2 | 0,1 | Na2CO3 | 0,5 | FeSO4, Na3PO4, Al(NO3)3 | |||
| CrCl3 | 0,025 | K3PO4 | 0,25 | Fe2(SO4)3 , Li3PO4, Cu(NO3)2 | |||
| Sr(NO3)2 | 0,01 | Na2SO4 | 0,1 | NaCl, ZnSO4, Na3PO4 | |||
| Pb(NO3)2 | 0,1 | KCl | 0,01 | K3PO4, CaCl2, Al2(SO4)3 | |||
| FeCl2 | 0,02 | Na2S | 0,01 | Na3PO4, Zn(NO3)2, Fe2(SO4)3 | |||
| BaCl2 | 0,02 | K3PO4 | 0,01 | Na3PO4, Ca(NO3)2, Fe2(SO4)3 | |||
| Na2CO3 | 0,01 | Ni(NO3)2 | 0,05 | K3PO4, CaCl2, Al2(SO4)3 | |||
| MnCl2 | 0,01 | Na2S | 0,05 | K3PO4, CaCl2, Al2(SO4)3 | |||
| Ni(NO3)2 | 0,01 | K2S | 0,02 | FeCl3, CuSO4, K3PO4 | |||
| Mg(NO3)2 | 0,01 | NaF | 0,05 | Al2(SO4)3, ZnCl2, Na3PO4 | |||
| AlCl3 | 0,05 | K3PO4 | 0,01 | ZnCl2, K3PO4, Fe2(SO4)3 | |||
| Ca(NO3)2 | 0,01 | K2CO3 | 0,02 | AlCl3, CuSO4, K3PO4 |
Т е м а 7
Общие свойства растворов
Задание. Рассчитайте температуру кипения и замерзания раствора, состав которого представлен в таблице 9.
Температуры кипения, кристаллизации, криоскопическая и эбуллиоскопическая постоянные чистых растворителей приведены в приложении 4.
Т а б л и ц а 9
| Номер варианта | Растворитель | Растворенное вещество | ||
| Вещество | масса, г | Вещество | масса, г | |
| Этанол С2Н5ОН | Сахароза С12Н22О11 | |||
| Вода Н2О | Мочевина (NH2)2СО | |||
| Уксусная кислота СН3СООН | Антрацен С14Н10 | 4,25 | ||
| Хлороформ СНCl3 | Пропеновая кислота С3Н4О2 | 7,2 | ||
| Этанол С2Н5ОН | Антраниловая кислота NH2C6H4COOH | 4,0 | ||
| Бензол С6Н6 | Камфора С10Н16О | 7,55 | ||
| Хлороформ СНCl3 | Нафталин С10Н8 | 2,35 | ||
| Вода Н2О | Глицерин С3Н5(ОН)3 | |||
| Этанол С2Н5ОН | Салициловая кислота С7Н6О3 | |||
| Сероуглерод СS2 | Бензойная кислота С6Н5СООН | 2,5 | ||
| Вода Н2О | Этиленгликоль (СН2)2(ОН)2 | 12,5 | ||
| Циклогексан С6Н12 | Пиррол С4Н5N | 0,25 |
О к о н ч а н и е т а б л. 9
| Номер варианта | Растворитель | Растворенное вещест |