1. В водных растворах каких солей лакмус (рТ=7) окрасится в синий цвет: а) СаCl2, б) Al2(SO4)3, в) NaNO3, г) Na2CO3?
2. Чему равна эквивалентная масса Н3РО4 в реакции
Н3РО4 + 3NaOH = Na3РО4 + 3H2O:
а) Э(Н3РО4) =  , б) Э(Н3РО4) =
, б) Э(Н3РО4) =  ,
,
в) Э(Н3РО4) =  , г) Э(Н3РО4) =
, г) Э(Н3РО4) = 
 .
.
3. Изучение химии элементов необходимо потому, что:
1) ……………..
2) ………………..
3) ………………
4) ……………….
4. В основе обмена веществ лежат такие физико-химические процессы, как:
……………
5. Общая химия объединяет избранные разделы из …………..
6. Электроотрицательность – это:
а) способность атома в соединении притягивать к себе электроны;
б) отдавать электроны;
в) изменять форму и энергию атомной орбитали;
г) изменять направленность химической связи;
7. Установите соответствие между реакцией и ее типом:
Реакция Тип реакции
Zn + 2НСl → ZnСl2 +2Н2О протолитическая
СН3СООН + Н2О → СН3СОО-- + Н3О+ окислительно -
восстановительная
СuSО4 + 2 NаОН → Сu(ОН)2 + 2Н2О комплексообразования
СuSО4 + 4КСN → К2[Сu(СN)4] + К2 SО4 ионообменная
8. К протолитическим (кислотно-основным реакциям) относятся следующие виды реакций:
9. Окисление - это процесс………, восстановление- процесс……….
10. Дописать реакции и уравнять: NО2 + Н2О  ………..
………..
NО2 + Н2О  ………..
………..
11. Установите соответствие между исходными веществами и продуктами их взаимодействия:
Исходные вещества Продукты реакции
А) Р + НNО3 (конц.) 1) Р2О5 + NО2 + Н2О
2) ZnSО4 + S + Н2О
Б) Р + НNО3 (разб.) 3) Н3РО4 + NО2 + Н2О
В) Zn + Н2SО4 (разб.) 4) Н3РО4 + NО
5) ZnSО4 + Н2
Г) Zn + Н2SО4 (конц.) 6) Р2О5 + NО + Н2О
7) ZnО + SО2 + Н2О.
12. Дописать реакции и уравнять: NН3 + О2 →……….
NН3 + О2  ….
….
13. Установите соответствие между исходными веществами и продуктами их взаимодействия:
Исходные вещества Продукты реакции
А) КMnО4 + Nа2SО3 + Н2SО4 1) MnО2 + К2SО4 + Н2О
Б) КMnО4 + Nа2SО3 + Н2О 2) К2MnО4 + К2SО4 + Н2О
В) КMnО4 + Nа2SО3 + КОН 3) К2MnО4 + Nа2SО4 + Н2О
4) MnSО4 + Nа2SО4 + К2SО4 +Н2О
5) MnО2 + Nа2SО4 + КОН
14. Установите, к какому типу ОВР относится реакция:
Реакция тип ОВР
А) Сl2 + 2КОН → КСl + КClО + Н2О 1) межмолекулярная
Б) 4КClО3→КСl+3КClО4 2) диспропорционирования
В) Мg + 2НСl → МgСl2 + Н2 3) внутримолекулярная
Г) 3S + 6NаОН→ 2Nа2S + Nа2SО3 +3Н2О
Д) 6СО2 + 6Н2О → С6Н12О6 + 6О2
Е) 2NаNО3 → 2NаNО2 + О2
15. Термодинамика изучает закономерности превращения ….
16. Система – это тело или группа тел, …
17.Гомогенными являются системы:
А) воздух и молоко,
Б) кровь и раствор СuCl2,
В) вода и раствор уксусной кислоты.
18.Гетерогенными являются системы:
А) воздух и молоко
Б) кровь и раствор извести
В) вода и раствор уксусной кислоты
19. Установите соответствие между типом системы и ее характеристиками:
Система Характеристики системы
А) открытая 1) ∆m = 0, ∆U≠ 0
Б) закрытая 2) ∆m = 0, ∆U= 0
В) изолированная 3) ∆m ≠ 0, ∆U≠ 0
20. Экстенсивными параметрами являются:
А) температура и масса,
Б) давление и концентрация,
В) объем и количество вещества.
21. Интенсивными параметрами являются:
А) температура и масса,
Б) давление и концентрация,
В) объем и количество вещества.
22. Внутренняя энергия системы складывается из суммы ………..и ………. энергии.
23. Обмен энергией между системой и внешней средой может осуществляться в виде ……. и ……..
24. В живых системах работа совершается за счет энергии, выделяющейся в ……..…. реакциях.
25. Работа, совершаемая в живых организмах, может быть …..…, ………… и ………….
26. Энтропия - это термодинамическая функция, характеризующая меру …… в системе.
27. Энтропия и информация связаны соотношением …….…
28. Формулировка I закона термодинамики:
29. Формулировка I закона термодинамики для изолированных систем:
30. Математическое выражение I закона термодинамики для закрытых систем:
31. Энтальпия - это термодинамическая функция, характеризующая …..…
32. Стандартная энтальпия образования простых веществ в их термодинамически устойчивом агрегатном и аллотропном состоянии равна….
33. Стандартная энтальпия образования сложного вещества равна энтальпии реакции получения ………….
34. По закону Гесса: «Энтальпия реакции не зависит от………….., а зависит только от…………
35. Калорийность жиров, белков и углеводов составляет …, …, … ккал/г соответственно.
36. Суточная потребность в жирах, белках и углеводах для взрослого человека составляет …, …, … соответственно.
37. Термохимия является разделом, который изучает
а) тепловые эффекты химических реакций;
б) направление протекания химического процесса;
в) механизмы химических реакций;
г) скорость реакции.
38. Реакция СН4+2О2=СО2+2Н2О+Q будет
а) экзотермической;
б) эндотермической;
в) реакцией обмена;
г) реакцией разложения.
39. Тело или совокупность тел, мысленно обособленных от окружающей среды называется
а) фазой;
б) системой;
в) параметром;
г) компонентом.
40. Термодинамическая функция энергии Гиббса определяется выражением
а)  ;
;
б)  ;
;
в)  ;
;
г) 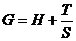 .
.
41. Количество теплоты, выделяемое или поглощаемое при разложении 1 моля сложного вещества на более простые называется
а) теплотой разложения;
б) теплотой растворения;
в) теплотой нейтрализации;
г) теплотой гидратации.
42. Однородная часть системы с одинаковыми химическими и термодинамическими свойствами, отделенная от других частей видимой поверхностью раздела называется
а) параметром;
б) фазой;
в) компонентом;
г) средой.
43. «В изолированной системе самопроизвольно могут протекать только те процессы, при которых ………»
44. Энергия Гиббса – это обобщенная термодинамическая функция состояния системы, учитывающая ……….…. при изобарно – изотермических условиях.
45.Энергию Гиббса можно вычислить через энтальпию и энтропию по формуле: …
46.«В изобарно – изотермических в системе самопроизвольно могут протекать только те процессы, при которых энергия Гиббса системы……»
47.Самопроизвольно могут протекать все экзотермические реакции, если они сопровождаются увеличением …….…
48.Биохимические реакции, которые сопровождаются ………., называются экзэргоническими реакциями. Они совершаются …….
49.Биохимические реакции, которые сопровождаются ………., называются эндэргоническими реакциями. Они не могут совершаться …….
50.Эндэргонической является реакция:
А) фотосинтеза
Б) гидролиза АТФ
В) синтеза сахарозы
Г) гидролиза креатинфосфата
51.Экзэргонической является реакция:
А) фотосинтеза
Б) гидролиза АТФ
В) синтеза сахарозы
Г) гидролиза креатинфосфата
52.Химическая кинетика изучает…… протекания реакций.
53. Истинная скорость химической реакции определяется как:
А) υ = |∆C| / ∆τ
Б) υ = dc / d τ
В) υ = k [А]а [В]в
54. Стадии сложных реакций могут протекать…….
55. Для реакции типа аА + bВ = сС + dD закон действующих масс можно записать в виде:
56. Если значения порядка реакции по реагентам совпадают со стехиометрическими коэффициентами, то это означает, что…
57. Температурный коэффициент реакции равен 3. Если увеличить температуру с 60 до 100 С, то скорость химической реакции возрастет в 1) 9 раз, 2) 12 раз, 3) 27 раз, 4) 81 раз.
58. Равновесные концентрации в реакции взаимодействия водорода и йода соответственно равны 0,02 моль/л и 0,03 моль/л, а равновесная концентрация [HI]=0,04 моль/л. Константа равновесия численно равна:
1) 3,12; 2) 4,21; 3) 2,30; 4) 2,67.
59. Реакциями нейтрализации называются… (привести примеры)
60. В основе метода кислотно-основного титрования лежит реакция (привести пример реакции):
61. Индикаторы – это …
62. Кислотно-основные индикаторы – это…
63.К индикаторам предъявляются следующие требования:
64.Индикаторы согласно ионной теории Оствальда – это…(привести примеры)
65. Одноцветные и двуцветные индикаторы – это…
66. В комплексных соединениях должна быть хотя бы одна связь, ………
67. В качестве комплексообразователей чаще всего выступают атомы или ионы ……….
68. Комплексообразователь- это атом или ион, который предоставляет ……….
69. Лиганды- это молекулы или ионы, которые являются ………….
70. Координационное число (число лигандов) обычно равно………..
71. Монодентатными являются лиганды:
А) этилендиамин и этанол,
Б) дианион щавелевой кислоты и иодид – ион,
В) ЕДТА и трилон Б,
Г) цианид – анион и аммиак.
72. Бидентатными являются лиганды:
А) этилендиамин и диметилглиоксим,
Б) дианион щавелевой кислоты и иодид – ион,
В) порфирин и трилон Б,
Г) цианид – анион и аммиак.
73. Комплексные соединения делятся на: ……….., ………., ………..
74. Установите соответствие между формулой комплексного иона и его геометрической формой:
Формула иона Геометрическая форма
А) [Аg(NН3)2]+ 1) квадратно –плоскостная
Б) [Ni(NН3)4]2+ 2) линейная
В) [Cu(NН3)4]2+ 3) октаэдрическая
Г) [SiF6]2- 4) тетраэдрическая
75. Чем меньше константа нестойкости комплексного соединения, тем …………. внутренняя сфера комплекса.
76. Алгебраическая сумма степеней окисления ионов-комплексообразователей в следующих комплексных ионах [Ni(NH3)5Cl]+, [AuCl4]– равна:
1) +2, 2) +4, 3) +5, 4) +6
77. Алгебраическая сумма степеней окисления комплексообразователей в соединениях: K[Ag(CN)2], Zn2[Fe(CN)6], K3[Al(OH)6] равна:
1) 0, 2) +2, 3) +4, 4) +6
78. Алгебраическая сумма степеней окисления ионов-комплексообразователей в следующих комплексных ионах: [Cu(NH3)4]2+, [PtCl6]2-, [Al(OH)6]3- равна:
1) +3, 2) +4, 3) +9, 4) +10
79. Алгебраическая сумма степеней окисления комплексообразователей в соединениях: Н[BF4], [Со(Н2О)6](NO2)3, Zn2[Fe(CN)6] равна
1) 0, 2) +5, 3) +6 4) +8
80. Растворы – это
а) однородные системы переменного состава
б) многокомпонентные системы, состав которых не может изменяться
в) это гетерогенные системы определенного состава
г) однокомпонентные системы
81. Молярная концентрация – это
а) число молей вещества в 1 л раствора;
б) число молекул вещества в 1 л раствора;
в) 0,1 моля вещества в 1 л раствора;
г) число молей растворенного вещества в 1 кг раствора.
82. Молярная концентрация эквивалента – это
а) число эквивалентов в 1 л раствора;
б) число молей в 1 л раствора;
в) число г/эк в 1 мл раствор;
г) число молекул в 1000 г растворителя.
83. Титр – это число:
а) молей вещества в 1 л раствора;
б) граммов вещества в 1 мл раствора;
в) грамм эквивалентов вещества в 1 л раствора;
г) граммов вещества в 1 л раствора.
84. Моляльная концентрация растворов – это:
а) Число эквивалентов вещества, содержащихся в 1 л раствора;
б) Отношение количества растворенного вещества в объему раствора;
в) Число грамм вещества, содержащихся в 1 л. раствора;
г) Число молей вещества в 1 кг растворителя.
85. Массовая доля – это
а) отношение массы растворенного вещества к массе раствора;
б) отношение массы растворенного вещества к массе растворителя;
в) отношение массы растворителя к массе раствора;
г) отношение массы растворенного вещества к объему растворителя.
86. Вещества растворы или расплавы, которых не проводят электрический ток, называются
а) электролитами;
б) неэлектролитами;
в) промоторами;
г) амфолитами.
87. Растворы по степени дисперсности относятся к
а) грубодисперсным системам;
б) коллоидно-дисперсным системам;
в) молекулярно-дисперсным системам;
г) микрогетерогенным системам.
88. Электролитами называют соединения………….. К ним относятся……….. Электролитической диссоциацией называется ………….
89. Причиной диссоциации является…………… Диссоциацию можно разделить на стадии………….
90.К сильным электролитам относятся ……………….(привести примеры).
91.К слабым электролитам относятся ……………….(привести примеры).
92. Процесс диссоциации слабых электролитов является……………… Диссоциацию электролита KtnAnm можно представить в виде…………..
93. Константу диссоциации для слабого электролита KtnAnm можно выразить формулой……………..
94. Многоосновные кислоты и многокислотные основания диссоциируют ступенчато, например, …………………
95. Степенью диссоциации электролита называется……………… Она зависит от…………….
96. По закону Оствальда связь между константой и степенью диссоциации слабого электролита выражается соотношением………….(привести формулу и дать формулировку закона)
97. Дебай и Хюккель предположили, что основной причиной резкого различия в свойствах сильных и слабых электролитов является…………
98. Кажущаяся степень диссоциации – это……….. Чем выше концентрация раствора, тем кажущаяся степень диссоциации…………..
99. Активность электролита – это ………………Она связана с концентрацией вещества формулой………………
100. Ионная сила раствора равна…………….(привести математическое выражение для вычисления I).
101. По закону Дебая – Хюккеля «В разбавленных растворах сильных электролитов с одинаковой ионной силой коэффициенты активности катионов и ……………………
102. Осадок гидроксида алюминия растворяется в кислотах и щелочах согласно уравнениям……………
103. Электролитической диссоциацией называется-
104. а) разложение молекул одного вещества на более простые молекулы
105. б) распад молекул на ионы в растворах или расплавах
106. в) соединения нескольких веществ в одно новое.
107. Сильными называют электролиты, которые…Приведите примеры.
108. Слабыми - называют электролиты, которые… Приведите примеры:
109. Константа ионизации слабого электролита - это отношение …
110. Степень диссоциации слабого электролита возрастает с разбавлением раствора. Это – а) закон Оствальда, б) закон Генри,
в) закон Рауля, г) закон Вант-Гоффа.
111. Распад молекул вещества на ионы в растворах или расплавах называется: а) гидролизом,
б) электролитической диссоциацией, в) гидратацией, г) высаливанием.
112. У сильных электролитов:
а) α > 50 % б) α > 30 % в) α < 29 % г) α = 20 %
113. Сильными электролитами являются:
а) CH3COOH б) KCl в) Na2SO4 г) Cu(OH)2
114. Сильными электролитами являются:
а) HF б) Fe(OH)3 в) HNO3 г) CH3COOK
115. По закону Дебая-Хюккеля «в разбавленных растворах сильных электролитов, с одинаковой ионной силой, коэффициенты активности катионов и анионов одинаковой зарядности равны …»
116. Эффективная концентрация, в соответствии с которой электролит участвует в различных процессах, является - а) ионной силой, б) активностью, в) ионным произведением воды.
117. Коэффициент активности характеризует
а) распад молекул на ионы,
б) концентрацию ионов,
в) взаимодействие ионов в растворе электролита.
118. Какие из утверждений верны:
А) кислотно-щелочное равновесие в крови и биожидкостях определяется содержанием слабых и сильных электролитов
Б) при длительной жажде увеличивается концентрация ионов
1) верно только А,
2) верно только Б,
3) верны оба утверждения,
4) оба утверждения неверны.
119. Концентрация всех содержащихся в растворителе осмотически активных частиц называется
а) молекулярностью,
б) осмомолекулярностью,
в) осмомолярностью.
120. Изотонический раствор это-
а) 0,3 % раствор хлорида натрия,
б) 10 % раствор хлорида натрия,
в) 0,9 % раствор хлорида натрия.
121. Если два раствора имеют различное осмотическое давление, то раствор с большим осмотическим давлением называется …, по отношению ко второму, а второй..., по отношению к первому.
122. Ионное произведение воды равно:
а) 10-14;
б) 10-4;
в) 10-10;
г) 10-8.
123. рН крови колеблется в пределах:
а) 7,3 – 7,5;
б) 5,3 – 5,6;
в) 8,1 – 8,5
г) 6,5-6,7.
124. Гидролизом соли называется ……………..
125. Количественно гидролиз характеризуется ……………….
126. Гидролизу могут подвергаться соли различных типов…………..(привести примеры гидролиза на каждый тип соли).
127. [Н+] для солей, образованных сильной кислотой и слабым основанием, равна…………….(привести формулу для расчета).
128.[Н+] для солей, образованных слабой кислотой и слабым основанием, равна…………….(привести формулу для расчета).
129.[Н+] для солей, образованных слабой кислотой и сильным основанием, равна…………….(привести формулу для расчета).
130. Молекулярные и ионные уравнения реакций постадийного гидролиза сульфита натрия имеют вид………….
131. Молекулярные и ионные уравнения реакций постадийного гидролиза карбоната натрия имеют вид………….
132. Молекулярные и ионные уравнения реакций гидролиза ацетата аммония имеют вид………….
133. Реакция среды в растворе сульфата алюминия ………….., потому что………..
134. Реакция среды в растворе сульфата меди (II) ………….., потому что………..
135. Реакция среды в растворе хлорида аммония ………….., потому что………..
136. При постепенном прибавлении к раствору сульфата алюминия раствора карбоната натрия выпадает осадок……………, так как….. (привести уравнения реакций).
137. Какова реакция среды раствора хлорида цинка ZnCl2
а) кислая;
б) щелочная;
в) нейтральная;
г) слабощелочная.
138. При гидролизе каких солей, реакционная среда кислая?
а) ZnCl2;
б) Na2CO3;
в) NaNO3;
г) (NH4)2CO3.
139. Гидролиз какой соли необратим?
а) СН3СООNa;
б) ZnCl2;
в) Al2S3;
г) NH4Cl.
140. Раствор какой соли имеет нейтральную среду?
а) NaCl;
б) AgCN;
в) CuCl2;
г) NH4NO3.
141. Раствор какой соли имеет щелочную среду?
а) K2SO4;
б) Cu(NO3)2;
в) K2CO3;
г) CH3COONa.
142. Na2SO4 – это соль образованная:
а) сильным основанием и сильной кислотой;
б) сильным основанием и слабой кислотой;
в) слабым основание и слабой кислотой;
г) сильной кислотой и слабым основанием.
143. При гидролизе соли АlCl3, раствор какую имеет среду?
а) кислую;
б) нейтральную;
в) основную;
г) щелочную.
144. (NH4)2SO4 – это соль образованна:
а) сильной кислотой и слабым основанием;
б) слабым основание и слабой кислотой;
в) сильным основанием и сильной кислотой;
г) слабой кислотой и сильным основанием.
145. Отношение числа молекул, подвергшихся гидролизу, к общему числу растворенных молекул, называют:
а) степенью гидролиза;
б) степенью диссоциации;
в) степенью окисления;
г) константой гидролиза.
146. Раствор соли NH4Cl имеет:
а) кислую среду;
б) нейтральную среду;
в) щелочную среду;
г) основную среду.
147. Значительную роль в поддержании постоянства _____________ биологических жидкостей, тканей и органов играют буферные растворы.
148. Буферные растворы – это …… (Привести примеры)
149. Буферные растворы по составу бывают двух основных типов:
1) ………
2) ………
(Привести примеры)
150. Каждая из буферных смесей характеризуется определенной концентрацией водородных ионов, которую буферная система и стремится сохранять при добавлении ……… или ………, а также при ………….
151. Вывод уравнения Гендерсона-Гассельбаха для буферных систем I типа (слабая кислота и ее соль (сопряженное основание):
………………….
152. Вывод уравнения Гендерсона-Гассельбаха для буферных систем II типа (слабое основание и его соль (донор протонов):
………………….
153. Механизм буферного действия ацетатной буферной системы:
……………………………………………… (Написать уравнения реакций)
154. Механизм буферного действия аммонийной буферной системы:
…………………………………………… (Написать уравнения реакций)
155. Механизм буферного действия фосфатной буферной системы:
……………………………………………… (Написать уравнения реакций)
156. Механизм буферного действия бикарбонатной буферной системы:
……………………………………………… (Написать уравнения реакций)
157. Мерой буферной емкости служит …
158. Буферной емкостью системы называется величина, ………..
159. Математически буферная емкость по кислоте определяется следующим образом: ……………………….., где ……….
160. Математически буферная емкость по щелочи определяется следующим образом:
…………………………………………….., где ………..
161. Будет ли поддерживать постоянным значение рН система, состоящая из 5 мл 0, 1 М NH3∙H2O и 5 мл 0,1 М NH4Cl, если к ней добавить 1 мл 0,01 М раствора NaOH?
1. да
2. нет
162. Будет ли поддерживать постоянным значение рН система, состоящая из 5 мл 0, 1 М HCl и 5 мл 0,1 М NaCl, если к ней добавить 1 мл 0,01 М раствора NaOH?
1. да
2. нет
163. Будет ли поддерживать постоянным значение рН система, состоящая из 5 мл 0, 1 М NaOH и 5 мл 0,1 М NaCl, если к ней добавить 1 мл 0,01 М раствора HCl?
1. да
2. нет
164. Будет ли поддерживать постоянным значение рН система, состоящая из 5 мл 0, 1 М NH3∙H2O и 5 мл 0,1 М NH4Cl, если к ней добавить 1 мл 0,01 М раствора HCl?
1. да
2. нет
165. Укажите, при смешивании каких растворов может образоваться система, обладающая буферным действием:
1. NaH2PO4 + NaCl
2. Na2SO4 + H2SO4
3. Na3PO4 + NaOH
4. Na2SO4 + NaOH
5. NaH2PO4 + Na2HPO4
166. Укажите, при смешивании каких растворов может образоваться система, обладающая буферным действием:
1. Na2SO4 + H2SO4
2. NaHSO3 + H2SO3
3. Na2SO3 + NaOH
4. NaHSO4 + H2SO4
5. NaHSO3 + H2SO4
167. Укажите, при смешивании каких растворов может образоваться система, обладающая буферным действием:
1. СН3СООК + СН3СООNa
2. СН3СООН + NaOH
3. СН3СООН + СН3СООNa
4. СН3СООН + С2H5OH
5. СН3СООК + НCl
168. Укажите, при смешивании каких растворов может образоваться система, обладающая буферным действием:
1. NH3∙H2O + NH4Cl
2. NH3∙H2O + NaOH
3. NH3∙H2O + NaCl
4. NH3∙H2O + НCl
5. NH4Cl + НCl
169. Выберите те утверждения, которые верно описывают биологическую роль бикарбонатной буферной системы
1. При избытке CO2, растворенного в плазме крови наблюдается ацидоз
2. При избытке CO2, растворенного в плазме крови наблюдается алкалоз
3. Буферная емкость бикарбонатной буферной системы выше по кислоте, чем по щелочи
4. Буферная емкость бикарбонатной буферной системы выше по щелочи, чем по кислоте
5. Бикарбонатная буферная система является эффективным физиологическим буфером вблизи рН, равным 7,4
6. Бикарбонатная буферная система наиболее значима в плазме крови
7. Бикарбонатная буферная система имеет преимущественное значение в клеточном секторе
170. Выберите те утверждения, которые верно описывают биологическую роль фосфатной буферной системы:
1) Фосфатная буферная система имеет преимущественное значение в клеточном секторе
2) Фосфатная буферная система наиболее значима в плазме крови
3) Буферные основания представлены в основном калийными солями фосфорной кислоты
4) В крови роль фосфатного буфера сводится в основном к поддержанию постоянства и воспроизводства бикарбонатного буфера
5) В крови роль фосфатного буфера сводится в основном к поддержанию постоянства и воспроизводства белкового буфера
6) Фосфатный буфер имеет наибольшее значение в таких биологических жидкостях, как моча и соки пищеварительных желез
171. Выберите те утверждения, которые верно описывают биологическую роль белковой буферной системы:
1) Белковая буферная система наиболее значима в плазме крови
2) Большое значение в подержании постоянства рН внутри живых клеток имеет белковая буферная система.
3) В крови работает анионный белковый буфер
4) В крови работает катионный белковый буфер
5) В крови работает катионный и анионный белковый буфер
6) Основную часть белков плазмы крови составляют альбумины и глобулины
7) Буферная емкость белковой буферной системы значительно выше по кислоте
8) Буферная емкость белковой буферной системы значительно выше по основанию
172. Кислотно-основное равновесие в плазме крови обеспечивается следующими буферными системами (Выберите правильные ответы):
1) гемоглобиновая
2) ацетатная
3) гидрокарбонатная
4) белковая
5) гидрофосфатная
6) аммонийная
173. Основные буферные системы живого организма:
1) …
2) …
3) …
4) …
174. Установите соответствие между составом буферной смеси и значением рН
1. 5 мл 0,1 М СH3COOH и 5 мл 0,1 М СH3COONa; рКa = 4,75
2. 5 мл 0,1 М NaHCO3 и 5 мл 0,1 М Na2CO3; рKa1 = 6,3, рKa2 = 10,3
3. 1 мл 0,1 М СH3COOH и 9 мл 0,1 М СH3COONa; рКa = 4,75
4. 5 мл 0,1 М NaHCO3 и 5 мл 0,1 М Н2CO3; рKa1 = 6,3, рKa2 = 10,3
а) рН=10,3
б) рН=4,75
в) рН=6,3
г) рН=5,7
д) рН=3,8
175. К коллигативным свойствам разбавленных растворов относят: ….
176.Раствор называют идеальным, если ….
177.Главной особенностью идеальных растворов является ….
178. Насыщенным называют пар ….
179. По закону Рауля: относительное понижение давления насыщенного пара растворителя над раствором ….
180. Абсолютное и относительное понижение давления пара над раствором соответственно равны: ….
181. Математическое выражение закона Рауля имеет следующий вид: ….
182. Температурой кипения жидкости является температура, при которой ….
183. Температурой замерзания жидкости является температура, при которой ….
184. Изучая замерзание и кипение растворов Рауль установил следующий закон: ….
185. Математическое выражение второго закона Рауля имеет следующий вид: ….
186. Физический смысл криометрической и эбулиометрической констант состоит в следующем …. Они зависят от ….
187. Измерение температур кипения и замерзания растворов лежит в основе ….
188. Молярные массы (кг/моль) неэлектролитов в криометрии и эбулиометрии рассчитывают по следующим формулам: ….
189. Диффузия – это ….
190. Закон Фика гласит: …. (привести формулу)
191. Посредством диффузии в биологических системах происходит ….
192. Гипертоническим называют раствор …, а гипотоническим – раствор ….
193. Осмосом называют ….
194. Осмотическим давлением называют величину, ….
195. С точки зрения термодинамики движущей силой осмоса является …, при этом энтропия системы (∆S) …, а Энергия Гиббса (G) ….
196. Эмпирическое уравнение расчета осмотического давления разбавленных растворов неэлектролитов имеет следующий вид: ….
197. Роль осмоса в биологических системах состоит в следующем: ….
198. Изотоническими называют растворы, ….
199. Лизисом называют ….
200. Явление плазмолиза – это ….
201. Понижение температуры замерзания раствора прямо пропорционально
а) моляльной концентрации;
б) молярной концентрации;
в) массовой доле;
г) нормальной концентрации.
202. Изотонические растворы – это растворы, имеющие
а) одинаковое осмотическое давление;
б) разное осмотическое давление;
в) одинаковое число молей;
г) одинаковый объем.
203. Понижение температуры замерзания раствора, вызванное растворением 1 моля неэлектролита в 1000 г растворителя называется
а) криоскопической постоянной;
б) эбулиоскопической постоянной;
в) постоянной Авогадро;
г) постоянной Больцмана.
204. Химическая кинетика изучает …
205. Молекулярность реакции показывает:
а) число элементарных стадий процесса;
б) число реагентов, участвующих в элементарном акте химического превращения;
в) число взаимодействующих молекул в момент столкновения;
г) порядок реакции.
206. Зависимость скорости простой реакции от концентрации выражает:
а) уравнение Вант-Гоффа;
б) уравнение Аррениуса;
в) закон действующих масс Гульдберга и Вааге;
г) уравнение Больцмана.
207. Температурный коэффициент реакции равен 2. При увеличении температуры с 22°С до 62°С скорость реакции
а) увеличится в 16 раз,
б) увеличится в 8 раз,
в) увеличится в 12 раз,
г) уменьшится в 16 раз.
208. Энергия активации Еа (кДж/моль) – это …
209. Катализатор – это …
210. Любая ферментативная реакция включает промежуточную стадию образования фермент-субстратного комплекса [ES] и его распад:
E + S [ES] E + P
Какие утверждения будут правильными для кинетики ферментативных реакций:
а) первая стадия протекает медленно, т.е. k3 > k1;
б) лимитирующей стадией является распад комплекса на продукты реакции и фермент, k1 > k2;
в) присоединение субстрата (S) к активному центру фермента (E) является самой медленной стадией процесса, т.е. k2 > k1;
211. По фазовому состоянию реагентов реакции подразделяются на …
212. Кинетическое уравнение реакции показывает зависимость скорости реакции от
а) температуры;
б) давления;
в) концентрации реагирующих веществ;
г) природы и фазового состояния реагентов.
213. Причиной увеличения скорости реакции при повышении концентрации веществ является увеличение:
а) числа столкновений молекул;
б) энергии молекул;
в) энергии активации процесса;
г) массы или объема вещества.
214. Для обычных химических реакций температурный коэффициент скорости реакции = …….., а для ферментативных реакций = ……..
215. Еа (энергия активации) зависит от:
а) температуры;
б) пути протекания реакции;
в) природы реагирующих веществ.
216. Виды катализа по изменению скорости:
а)
б)
по фазовому состоянию реакционной смеси и катализатора:
а)
б)
217. Определить взаимосвязь между специфическим свойством фермента и условием его проявления:
| а) высокая каталитическая активность | 1) Мферментов = 105 ÷ 107 (а.е.м). |
| б) высокая специфичность | 2) необходимость определенных условий: рН среды и t (36-38°C). |
| в) ультрамикрогетерогенность | 3) структура активного центра фермента является точным шаблоном структуры молекулы субстрата. |
218. Чем отличается протекание гомогенной реакции от гетерогенной?
219. Порядок реакции по реагенту – это
а) показатель степени при концентрации данного реагента в кинетическом уравнении, равный стехиометрическому коэффициенту данной сложной реакции;
б) показатель степени, в которую надо возвести данного реагента в кинетическом уравнении для сложной реакции, чтобы вычисленная по этому уравнению скорость была равной скорости, найденной экспериментально;
в) величина, позволяющая вычислить молекулярность реакции.
220. Найти соответствие между кинетическими уравнениями для скорости и константы скорости и порядком реакции, которому они соответствуют:
а) реакция нулевого порядка 1) v =kC2
2) k = 1/t
б) реакция первого порядка 3) v = kC0 = k
4) v = kC
в) реакция второго порядка 5) K = 1/t
6) K = 1/t
221. Сильное влияние температуры на скорость химической реакции объясняет теория активных соударений. Основные положения этой теории:
1)
2)
3)
222. Уравнение Аррениуса  отражает зависимость …, где А (коэффициент Аррениуса) – учитывает …
отражает зависимость …, где А (коэффициент Аррениуса) – учитывает …
223. Причина увеличения скорости реакции катализатором:
а) увеличение числа столкновений частиц;
б) увеличение энергии активации молекул;
в) уменьшение времени протекания реакции;
г) изменение пути реакции и снижение энергетического барьера.
224. Уравнение Михаэлиса-Ментен отражает зависимость стационарной скорости ферментативной реакции Vст от концентрации субстрата [S]:
225. Установить соответствие между величиной и формулой для ее определения:
а) средняя скорость гомогенной реакции 1) 
б) средняя скорость гетерогенной реакции 2) 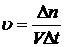
в) истинная скорость 3) 
226. Выберите 2 верных утверждения:
а) порядок реакции определяет характер зависимости скорости от концентрации;
б) порядок реакции может быть целой, дробной и даже отрицательной величиной. Это зависит от вида кинетического уравнения и соотношения реагентов;
в) порядок реакции – это целая величина показывающая молекулярность данной реакции;
г) порядок реакции – это основной кинетический параметр, не зависящий от соотношения реагентов и механизма данной реакции.
227. Период полупревращения реагента t½ - это …
228. Какая связь между энергией активации и скоростью реакции?
229. Особенностями ферментативных реакций являются:
а) специфичность;
б) многостадийность;
в) самоускорение;
г) цикличность изменения концентраций;
д) микрогетерогенность.
230. Температурный коэффициент реакции равен 3. При уменьшении температуры с 60°С до 20°С скорость реакции
а) увеличится в 81 раз в) увеличится в 64 раза
б) уменьшится в 81 раз г) уменьшится в 64 раза
231. Химическое равновесие наблюдается при
а) υ1= υ2,
б) υ2> υ1,
в) υ1> υ2,
г) υ1≤ υ2.
232. Для систем, находящихся в химическом равновесии применяется
а) принцип Ле–Шателье,
б) правило Вант-Гоффа,
в) принцип Паули,
г) принцип минимальной энергии.
233. Обратимые реакции – это реакции, которые идут
а) в двух противоположных направлениях,
б) идут в одном направлении,
в) идут в обратном направлении,
г) идут в прямом направлении.
234. Необратимые химические реакции – это ре