Кислотносты по Бренстеду
В принципе, большинство органических соединений можно рассматривать как кислоты, поскольку в органических соединениях Н связан с С, N O S
Органические кислоты соответственно делятся на С – Н, N – Н, О – Н, S-Н – кислоты. 

Кислотность оценивается в виде Ка или - lg Ка = рКа, чем меньше рКа, тем сильнее кислота.
Количественная оценка кислотности органических соединений определена далеко не у всех органических веществ. Поэтому важно выработать умение проводить качественную оценку кислотных свойств различных кислотных центров. Для этого используют общий методический подход. Сила кислоты определяется стабильностью аниона(сопряженного основания). Чем стабильнее анион, тем сильнее кислота.
При оценке кислотности соединений с одинаковым атомом в кислотном центре определяющим фактором является делокализация отрицательного заряда в анионе. Стабильность аниона значительно повышается с появлением возможности делокализации отрицательного заряда по системе сопряженных связей. Значительное увеличение кислотности в фенолах, по сравнению со спиртами объясняется возможностью делокализации в ионах по сравнению с молекулой.
Основность по Бренстеду
Для того, чтобы образовать связь с протоном, необходимо не поделенная электронная пару у гетероатома,
либо быть анионами. Существуют π-основания, где центром основности являются
электроны локализованной π-связи или π-электроны сопряженной системы (π-компоненты) 
Сила основания зависит от тех же факторов, что и кислотность, но влияние их противоположно. Чем больше электроотрицательность атома, тем прочнее он удерживает неподеленную пару электронов, и тем менее доступна она для связи с протоном. Тогда в целом сила n-оснований с одинаковым заместителем изменяется в ряду:N > O > S
Наибольшую основность из органических соединений проявляют амины и спирты:
Соли органических соединений с минеральными кислотами хорошо растворимы. Многие лекарственные средства используют в виде солей.
Кислотно-основной центр в одной молекуле(амфотерность) 
Примером такой молекулы может быть α -аминокислота.

Водородные связи как кислотно-основное взаимодействие
Для всех α – аминокислот является преобладание катионных форм в сильнокислых и анионных в сильнощелочных средах.
Наличие слабых кислотных и основных центров приводит к слабым взаимодействиям – водородным связям. Например: имидазол при небольшой молекулярной массе имеет высокую температуру кипения за счет наличия водородных связей.
Дж. Льюисом предложена более общая теория кислот и оснований, определяющаяся на строении электронных оболочек.
Кислотами по Льюису могут быть атом, молекула или катион, обладающие вакантной орбиталью, способное принимать пару электронов с образованием связи.
Основания Льюиса атом, молекула или анион способный предоставлять пару электронов. К основаниям Льюиса относятся амины, спирты, простые эфиры, тиолы, тиоэфиры и содержащие π-связи соединения.
Например, приведенное ниже взаимодействие можно представить как взаимодействие кислот и оснований Льюиса
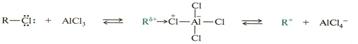
Важным следствие теории Льюиса является то, что любое органическое вещество можно представить как кислотно-основной комплекс.
В органических соединениях внутримолекулярные водородные связи возникают значительно реже, чем межмолекулярные, но также имеют место в биоорганических соединениях и их можно рассматривать как кислотно-основные взаимодействия.
5.Субстрат – молекула, которая предоставляет атом углерода для образования новой связи
Реагент - действующее на субстрат соединение.
Реакции по характеру изменения связей в субстрате и реагенте можно разделить на:
Радикальные R
Электрофильные Е
Нуклеофильные N (Y)