РЕФЕРАТ
По дисциплине: Молекулярные основы гормональной регуляции
На тему: «Биохимия обестатина»
Выполнил: студент 4 курса 1 группы ВБФ
Юмашев К.В.
Преподаватель:
Доцент кафедры, к.б.н.
Зарудная Е. Н.
Москва 2020 г
Оглавление
Введение. 3
Химическая природа. 4
Биосинтез,хранение,секреция. 6
Механизм действия. 9
Биохимические функции. 11
В бетта клетках. 11
В жировой ткани. 14
Обестатин в физиологической и неопластической клеточной пролиферации. 18
Влияние обестатина на сон, чувства и память. 21
Заключение. 22
Список литературы.. 23
Введение
Процессы питания и пищевого поведения организма контролируются сложной системой, центральным звеном которой является гуморальная регуляция. Ведущую роль в регуляции играют желудочно-кишечные, или гастроинтестинальные, гормоны, представляющие собой полипептиды и амины. Источником этих соединений служат эндокринные клетки слизистой оболочки желудка, 12-перстной кишки, поджелудочной железы и кишечника. В настоящее время известно более 20 гастроинтестинальных гормонов и биологически активных веществ, отвечающих за поддержание метаболического и энергетического баланса организма. К наиболее важным гормонам относят грелин, лептин, холецистокинин, адипонектин, нейропептид YY, обестатин. Желудочно-кишечные гормоны оказывают регуляторное влияние на клетки-мишени различными способами: эндокринным (доставляются к органаммишеням общим и региональным кровотоком), паракринным (диффундируют через интерстициальную ткань к рядом расположенной клетке), все они продуцируются также нервными клетками и играют роль нейротрансмиттеров.
История
В 2005 году J.V. Zhang и соавторы, благодаря компьютерному анализу генома человека, идентифицировали обестатин[19]. Изначально данный гормон позиционировался как полный антагонист грелина, уменьшающий аппетит и ингибирующий секрецию гормона роста.
Химическая природа
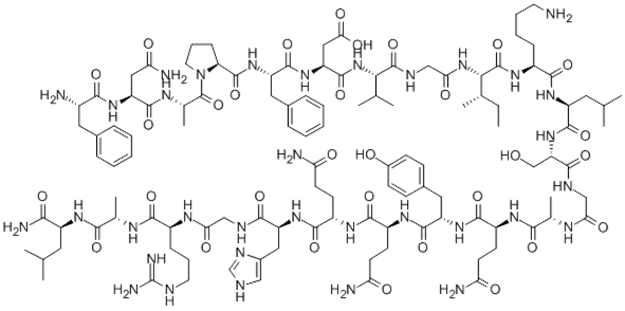
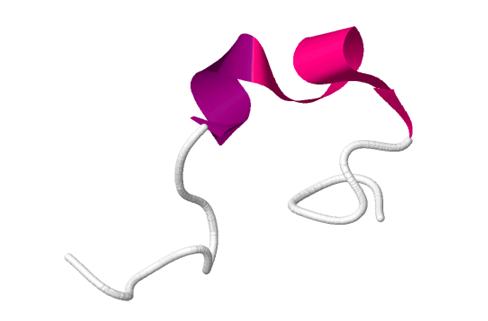 Рис.1 Формула обестатин
Рис.1 Формула обестатин
Рис.2 Структура обестатина при ЯМР спектроскопии.
Обестатин, пептид из 23 аминокислот с молекулярной массой 2516,3D был получен из предшественника препрогрелина состоящего из 117 остатков, что и грелин. Первоначально был очищен от слизистой оболочки желудка крысы. Его аминокислотная последовательность FNAPFDVGIKLSGAQYQQHGRAL.ОбестатинпредаставленС-концом, полученным из препрогрелина и образующий α-спираль. Хотя обестатин имеет короткий биологический период полураспада и быстро разлагается, предлагается оказывать широкомасштабные патофизиологические действия [1].
Название «obestatin» - сокращение от ожирения, которое происходит от латинского «obedere», что означает «пожирать» и «статин», что указывает на подавление. Чжан и соавт. назвал недавно открытый пептид «обестатин» за его способность ингибировать потребление пищи у мышей при введении периферически или в желудочки мозга. Детальный анализ с использованием ядерного магнитного резонанса и спектроскопии кругового дихроизма показал, что обестатин человека и мыши, а также фрагменты обестатина человека: (6–23), (11–23) и (16–23), приняли альфа-спиральное вторичное структура, несмотря на их различные последовательности [2]. Представляется вероятным, что эта характерная структура необходима для связывания обестатина с его рецептором, хотя конкретные вовлеченные домены еще предстоит определить.
 Биосинтез,хранение,секреция
Биосинтез,хранение,секреция
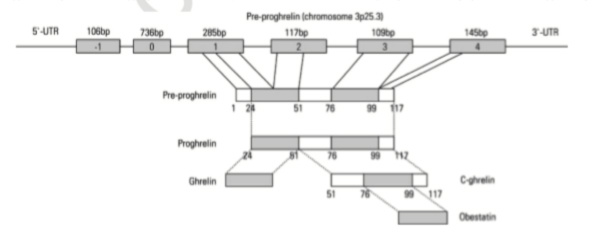
Рис.3 Биосинтез обестатина.
Обестатинявляется продуктом гена грелина ивырабатывается преимущественно желудком; однако его экспрессия была продемонстрирована в других тканях, включая поджелудочную железу, жировую ткань, скелетные мышцы, печень, легкое, щитовидную железу, молочную железу и яичко, что указывает на аутокринные / паракринные эффекты.Обестатин функционирует как часть сложной сети кишечника и мозга, благодаря которой гормоны и вещества из желудка и кишечника сигнализируют мозгу о сытости или голоде. Однако возникает вопрос о том, когда синтезируется обестатин[2]. Секреция обестатина является пульсирующей и проявляет ультрадианную ритмичность, аналогичную секреции грелина, но уровни грелина и обестатина в плазме строго не коррелируют, и число пульсирующих эпизодов обестатина может показаться немного ниже, чем наблюдаемое для секреции грелина. В отличие от грелина, обестатин, по-видимому, действует как аноректический гормон, снижая потребление пищи, замедляя опорожнение желудка и подвижность тощей кишки, и снижая прирост массы тела у грызунов, Хотя грелин часто называют гормоном голода, последние данные показывают, что его физиологическая функция заключается не в том, чтобы стимулировать питание, а скорее в том, чтобы подготовить организм к поступлению питательных веществ. На самом деле, Лю и соавт. продемонстрировали, что уровни ацилированногогрелинаповышаются перед едой, а затем снижаются, в то время как концентрации ацилгрелина в плазме не увеличиваются в условиях длительного голодания, что свидетельствует о роли сигнала голода для грелина. Гронберг и соавт. обнаружили, что субклеточная локализация обестатина и грелина по существу идентична, что указывает на то, что обестатин и грелин хранятся в одних и тех же секреторных пузырьках. Обестатин присутствует не только в желудочно-кишечном тракте, но также в селезенке, молочной железе, грудном молоке и плазме. Он также сохраняется в последовательностях препрогрелина 11 различных видов млекопитающих, и предсказанная последовательность обестатина, а также грелина, идентична у крыс и мышей. Таким образом, имеется достаточно доказательств того, что обестатин играет ключевую роль в метаболических процессах, общих для всех этих различных видов, включая людей.Ген грелина, кодирующий 117-аминокислотный пептид – прогрелин и расположенный у человека на 3 хромосоме, состоит из 4 экзонов и 3 интронов. Прогрелин расщепляется и превращается в 28-аминокислотный пептид грелин, который секретируется в кровь[3]. Грелин претерпевает посттрансляционные модификации, в результате чего выявляются две его формы: неацилированныйгрелин и ацилированныйгрелин.Посттрансляционная модификация грелина, необходимаядля его функциональной активности и возможного перехода в обестатин осуществляется ферментом О-ацил-трансферазой (ГОАТ, GOAT), находящемуся на мембране клеток, производящих грелин в желудке и поджелудочной железе. Грелинацилируетсяпо 3-му остатку серина (Ser3) грелин-О-ацилтрансферазой.
Обестатин и грелин в основном продуцируются по всему желудочно-кишечному тракту (например, желудок, поджелудочная железа и двенадцатиперстная кишка) с преобладающей экспрессией в слизистой оболочке желудка,хотя их распределение является несколько видоспецифичным. Например, у крысы обестатин обнаруживается в желудочно-кишечном тракте, в A-подобных клетках и оксинитных железах слизистой оболочки желудка и холинергических нейронах мицеллярного сплетения, а также в клетках Лейдига яичка, где он локализуется совместно. с его предшественником пептидом, препрогрелином. Обестатин также экспрессируется в мозге, где он стимулирует передачу сигналов кальция посредством стимуляции внутриклеточного высвобождения накопления кальция, что может опосредовать некоторые из его предполагаемых центральных действий[3]. У людей большая часть производства обестатина локализуется в желудочно-кишечном тракте, с преобладанием в желудке по сравнению с двенадцатиперстной кишкой, тощей кишкой и подвздошной кишкой (где он специфически обнаруживается в криптах либеркуновских и бруннеровских желез) и отсутствием в толстой кишке, в то время как обестатин также экспрессируется как на периферии панкреатических островков, так и в экзокринных протоках поджелудочной железы. Кроме того, и обестатин, и грелин были идентифицированы в эпителиальных протоках молочной железы человека, причем грелин-позитивные клетки обнаружены в некоторых раковых опухолях молочной железы и клеточных линиях. Как только обестатин попадает в кровоток, он быстро разрушается рядом протеаз, таких как аминопептидаза и постпролилэндопептидаза, которые в основном находятся в крови, печени и почках. Его период полураспада в плазме является критическим фактором, определяющим, способен ли обестатин достигать и воздействовать на ткани-мишени, а опубликованные данные по грызунам сильно варьируют. Например, период полураспада нативного мышиного обестатина в плазме мышей составляет 42,2 мин по сравнению с 12,6 мин в печени и 138 мин в почечных мембранах, в то время как период полураспада обестатина грызунов в гомогенате печени крыс был определен как 21,7 мин[4].
Механизм действия
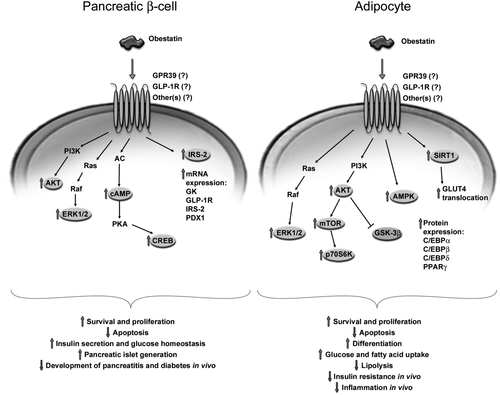
Рис.4 Механизм действия обестатина
Внутриклеточные сигнальные пути активируются обестатином в β-клетках поджелудочной железы и адипоцитах. При связывании рецептора обестатин активирует различные пути, которые, как известно, участвуют в выживании и пролиферации клеток, ингибировании апоптоза и дифференцировке клеток. Обестатин также модулирует метаболизм глюкозы путем увеличения секреции инсулина в β-клетках, а также поглощения глюкозы в адипоцитах. Кроме того, обестатин регулирует липидный обмен в адипоцитах, либо стимулируя адипогенез и поглощение свободных жирных кислот, либо ингибируя липолиз. В естественных условияхобестатин предотвращает развитие панкреатита у мышей и диабета, вызванного стрептозотоцином, у крыс и снижает резистентность к инсулину с высоким содержанием жиров и воспаление у мышей[5]. GLP-1R, глюкагоноподобный пептид-1 рецептор; GPR39, G-белок-связанный рецептор 39; PI3K / Akt, фосфатидилинозитол-3-киназа / Akt; ERK1 / 2, регулируемая внеклеточным сигналом киназа 1/2; AC, аденилатциклаза; цАМФ, циклический АМФ; ПКА, протеинкиназа А; CREB, белок, связывающий элемент ответа cAMP; IRS ‐ 2, субстрат рецептора инсулина ‐ 2; ГК, глюкокиназа; PDX1, гомеобокс поджелудочной железы и двенадцатиперстной кишки ‐ 1; mTOR, мишень рапамицина для млекопитающих; p70S6K, p70 S6 киназа; AMPK, AMP-активированная протеинкиназа; GSK-3β, гликогенсинтаз-киназа-3β; SIRT1, сиртуин 1; GLUT4, транспортер глюкозы 4; C / EBP, CCAAT / энхансер, связывающий белок; PPARγ, рецептор-гамма, активируемый пролифераторомпероксисом.
В то время как рецептор, посредством которого грелин оказывает свое действие, хорошо известен, существуют противоречивые мнения относительно типа рецептора обестатина. Чжан и соавт. сообщили, что обестатин является родственным лигандом для связанного с G-белком рецептора-39 (GPR39). Лечение обестатином индуцировало экспрессию c-fos у мышей дикого типа, но не у GPR39 null, таким образом, обеспечивая дальнейшую поддержку взаимосвязи лиганд-рецептор между обестатином и GPR39. Недавние сообщения указывают на то, что обестатин вряд ли является эндогенным лигандом для GPR39. Chartreletal. предоставили независимые доказательства того, что обестатин не взаимодействует с GPR39, не наблюдая влияния обестатина на GPR39-трансфицированные клетки в различных функциональных анализах. В исследовании мышей, нокаутированных по GPR39, был сделан вывод, что GPR39, возможно, не является рецептором обестатина[5]. Кроме того, Granata et al. сообщили, что обестатин способствует выживанию бета-клеток и островков человека, связываясь с рецептором глюкагоноподобного пептида-1 (GLP-1R), рецептором, через который действуют инкретины. Аналогично, инкретины также снижают моторику желудочно-кишечного тракта с помощью паракринного периферического действия, вызывают сытость и уменьшают потребление пищи (задний мозг), особенно в постреме и ядре одиночного тракта). На сегодняшний день рецептор обестатина остается неизвестным, и необходимы дальнейшие исследования, чтобы выявить точную связь между обестатином, GPR39 и GLP-1R.
Биохимические функции
В бетта клетках
Диабет типа 1 и типа 2 характеризуется снижением массы β-клеток, главным образом вследствие апоптоза; поэтому идентификация новых молекул, способных стимулировать выживание и функционирование β-клеток, является одной из основных целей разработки новых терапевтических стратегий борьбы с диабетом[6]. Обестатин может представлять собой подходящую мишень, поскольку недавно было обнаружено, что он способствует выживанию и пролиферации и снижает апоптоз в β-клетках поджелудочной железы и островках поджелудочной железы человека, культивируемых либо в условиях голодания в сыворотке, либо в присутствии воспалительных цитокинов. Сигнальные пути, вовлеченные в эти эффекты, включали увеличение цАМФ, фосфорилирование выживаемости и пролиферативные пути, такие как фосфатидилинозитол-3-киназа (PI3K) / Akt и внеклеточная сигнальная киназа (ERK) 1/2.Обестатин также стимулировал экспрессию и фосфорилирование мРНК субстрата рецептора инсулина 2 (IRS-2), которая участвует как в передаче сигналов рецептора инсулина и GLP-1R, так и в активированном белке, связывающем элемент ответа cAMP, главный регулятор глюкозы. гомеостаз и выживание β-клеток. Кроме того, гены обестатина активируются, которые играют ключевую роль в выживании, дифференцировке β-клеток и секреции инсулина, индуцированной глюкозой, такие как панкреатический и дуоденальный гомеобокс 1, IRS-2 и глюкокиназа[7]. Предполагалось, что эти эффекты включают в себя активацию и передачу сигналов через GLP-1R из-за сильного сходства действий обестатина и GLP-1 в панкреатических β-клетках. Это предположение было подтверждено результатами, показывающими, что эффект выживания обестатина в β-клетках теряется в присутствии антагониста GLP-1R эксендина-9, и что обестатин активирует экспрессию мРНК GLP-1R и способен связываться с GLP-1R хотя со сродством ниже, чем GLP ‐ 1. Кроме того, эффекты выживания обестатина в β-клетках были снижены в присутствии антагониста рецептора грелина [ d- Lys3] -GHRP-6, и было обнаружено, что грелин распознает сайты связывания, которые являются общими как для грелина, так и для деацилгрелина, что указывает на перекрестные разговоры о разных пептидах[8].Интересно, что антиапоптотическое действие обестатина, грелина и дезацилгрелина недавно наблюдалось в клетках микроэндотелиальных островков поджелудочной железы человека (МЭК), подверженных хронической гипергликемии, где эффекты и сигнальные механизмы, индуцируемые пептидами, были сопоставимы и также сходны с таковыми у GLP-1R агонист exendin-4. Таким образом, была предложена положительная роль пептидов, происходящих из гена грелина, в улучшении васкуляризации островков и, как следствие, функции островковых клеток[9].
Недавно было обнаружено, что обестатин также способствует образованию β-клеток invitro из клеток-предшественников, полученных из островков поджелудочной железы мыши. В культивируемых островках поджелудочной железы мыши обестатин способствовал выживанию клеток, уменьшал апоптоз и увеличивал количество клеток, положительных по отношению к нестину, мезенхимальному / нейрональному маркеру, связанному с предшественниками поджелудочной железы. Обестатин также индуцировал образование кластеров островковых клеток (ICC), которые демонстрировали повышенную экспрессию генов инсулина и секрецию C-пептида по сравнению с необработанными ICC. Кроме того, лечение обестатином также улучшилось в пробиркеэндокринная дифференциация ICC, вероятно, посредством подавления рецепторов фактора роста фибробластов (FGFR), селективной модуляции рецепторов Notch и своевременной индукции нейрогенина 3 (Ngn3). Эти данные могут указывать на возможные последствия применения обестатина в качестве мишени для клеточной заместительной терапии при диабете. Более того, индуцированная обестатином модуляция путей развития FGFR / Notch / Ngn3, наряду с его экспрессией в поджелудочной железе плода, предполагает роль в регенерации и формировании поджелудочной железы[9].
Invivo было обнаружено, что обестатин, такой как грелин и деацилгрелин, способен снижать диабет во взрослом возрасте у крыс, получавших в неонатальном возрасте стрептозотоцин (STZ), путем снижения уровня глюкозы, повышения уровня инсулина в плазме и поджелудочной железы и сохранения массы β-клеток, вероятно, через антиапоптотические механизмы. В поджелудочной железе обестатин также оказывает противовоспалительное действие, так как было обнаружено, что он уменьшает панкреатит у крыс путем снижения сывороточного уровня провоспалительного интерлейкина-1β 43.
Что касается секреции инсулина, роль обестатина все еще остается противоречивой, поскольку были продемонстрированы как ингибирующие, так и стимулирующие эффекты. Было показано, что обестатин, даже более эффективный, чем грелин, ингибирует секрецию инсулина в изолированных островках мышей и крыс, стимулирует секрецию глюкагона и ингибирует секрецию соматостатина и полипептида поджелудочной железы. Другие исследования показали, что обестатин либо ингибировал высвобождение инсулина invivo у крыс и в изолированных островках поджелудочной железы крыс, либо не оказывал влияния на секрецию инсулина в базальных условиях или при голодании у крыс и мышей,напротив, в перфузированной поджелудочной железе крысы было обнаружено, что обестатин либо усиливает, либо ингибирует секрецию инсулина при использовании в низких или в высоких концентрациях, соответственно, и усиливает стимулирующее действие аргинина и толбутамида на секрецию инсулина [10]. Аргинин является аминокислотой, которая деполяризует β-клетку, таким образом, вызывая открытие зависимых от напряжения каналов Ca 2+. Известно, что толбутамид, подобно глюкозе, закрывает АТФ-зависимые K + каналы, и стимулирующего эффекта обестатина на секрецию инсулина, индуцированную глюкозой, не наблюдалось в присутствии диазоксида, открывающего K + канал, что свидетельствует о том, что АТФ-зависимый К + каналы чувствительны к обестатину.
Обестатин-индуцированное высвобождение инсулина в ответ на глюкозу также было описано invitro, на линиях β-клеток и островках поджелудочной железы человека, и invivo, на островках поджелудочной железы мышей, получавших диету как с низким, так и с высоким содержанием жира.
Стимулирующее действие обестатина на секрецию инсулина дополнительно подтверждается данными о взаимодействии пептидов с GLP-1R, а также участием GLP-1R в выживании и метаболических эффектах обестатина в β-клетках поджелудочной железы и адипоцитах.
В жировой ткани
Контроль накопления энергии в организме и гомеостаз глюкозы считаются основными признаками жировой ткани. Когда требуется энергия, начинается липолиз, и свободные жирные кислоты (СЖК) высвобождаются из запасов триглицеридов жировой ткани непосредственно в циркуляцию; (СЖК) затем окисляются другими органами, такими как скелетные мышцы, обеспечивая тем самым энергию. Кроме того, жировая ткань является важным эндокринным органом, способным секретировать различные белки и цитокины, а именно адипокины, воздействуя либо на дистальные ткани, либо аутокринно-паракринно, которые способны влиять на метаболизм глюкозы и липидов, энергетический баланс и воспаление[11]. Дерегуляция этих мелких процессов может вызвать осложнения, такие как резистентность к инсулину и диабет. Ожирение часто связано с сердечно-сосудистыми заболеваниями, дислипидемией, стеатозом печени и появлением сахарного диабета 2 типа (СД2). Системные последствия характеризуются повышенным уровнем глюкозы и СЖК в крови, а также выраженной инсулинорезистентностью.
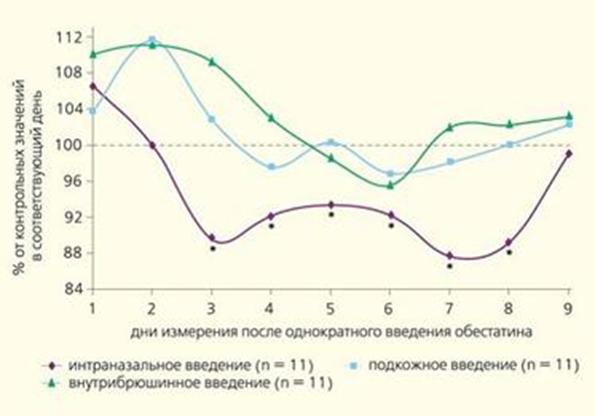 Недавно было показано, что обестатин оказывает положительное влияние на функцию адипоцитов как invitro, так и invivo. Более того, специфическое связывание с обестатином было продемонстрировано в преадипоцитах 3T3-L1, преадипоцитах подкожных клеток человека (SC) и дифференцированных клеточных мембранах адипоцитов. Что касается рецептора обестатина, хотя GPR39 подвергается серьезному сомнению, связывание обестатина с GPR39 было продемонстрировано в различных тканях и клетках, экспрессирующих GPR39, включая белую жировую ткань (WAT). Внутрибрюшинная инъекция обестатина усиливала окрашивание c-fos в ядрах слизистой оболочки желудка, кишечных ворсинок и белых жировых тканей. Более того, в культивируемых преадипоцитах 3T3-L1 обестатин увеличивал экспрессию гена раннего ответа c-fos и фосфорилирование ERK1 / 2. Эти эффекты включали GPR39, о чем свидетельствуют исследования связывания и отсутствие вызванного обестатином увеличения c-fos у GPR39 нулевых мышей[12].
Недавно было показано, что обестатин оказывает положительное влияние на функцию адипоцитов как invitro, так и invivo. Более того, специфическое связывание с обестатином было продемонстрировано в преадипоцитах 3T3-L1, преадипоцитах подкожных клеток человека (SC) и дифференцированных клеточных мембранах адипоцитов. Что касается рецептора обестатина, хотя GPR39 подвергается серьезному сомнению, связывание обестатина с GPR39 было продемонстрировано в различных тканях и клетках, экспрессирующих GPR39, включая белую жировую ткань (WAT). Внутрибрюшинная инъекция обестатина усиливала окрашивание c-fos в ядрах слизистой оболочки желудка, кишечных ворсинок и белых жировых тканей. Более того, в культивируемых преадипоцитах 3T3-L1 обестатин увеличивал экспрессию гена раннего ответа c-fos и фосфорилирование ERK1 / 2. Эти эффекты включали GPR39, о чем свидетельствуют исследования связывания и отсутствие вызванного обестатином увеличения c-fos у GPR39 нулевых мышей[12].
Рис.5 Динамика потребления корма после однократного введения обестатина в дозе 300 нМ/кг.
Помимо его связывания с адипоцитами, экспрессия и секреция обестатина были продемонстрированы в крысиных WAT, мышиных адипоцитах 3T3-L1 и в человеческих SC и сальниковых (OM) WAT, что указывает на аутокринные / паракринные действия пептида, вероятно, в адипогенезе. Фактически, дифференцирующиеся адипоциты показали повышенную экспрессию обестатина, а нейтрализация обестатина антителами против обестатина снижала адипогенезinvitro. Роль GLP-1R была недавно продемонстрирована в адипогенезе, пролиферации адипоцитов и профилактике апоптоза. Недавно было обнаружено, что обестатин демонстрирует частичное связывание с GLP-1R в β-клетках поджелудочной железы, что, по крайней мере, частично объясняет его инсулинотропный эффект и выживаемость в этих клетках[12]. Аналогично, в преадипоцитах 3T3-L1, преадипоцитах SC человека и дифференцированных адипоцитах связывание обестатина замещалось агонистом GLP-1R Ex-4 и антагонистом Ex-9 и уменьшалось с помощью небольшой интерферирующей РНК (siRNA) против GLP-1R, предполагая взаимодействие обестатина с GLP ‐ 1R. Дополнительные исследования будут необходимы, чтобы уточнить, можно ли считать обестатин новым лигандом GLP-1R.
Различные исследования показали, что как грелин, так и дезацилгрелин оказывают различные воздействия как invivo, так и invitro на модуляцию потребления пищи, энергетический обмен, адипогенез, липолиз и поглощение жирных кислот. Точно так же недавно было показано, что обестатин проявляет различные действия в адипоцитах, регулируя функцию адипоцитов, а также метаболизм липидов и глюкозы. Обестатин оказывает пролиферативное и антиапоптотическое действие в адипоцитах 3T3-L1 посредством активации путей PI3K / Akt и ERK1 / 2. Кроме того, он способствует дифференцировке как адипоцитов 3T3-L1, так и адипоцитов SC и OM человека и увеличивает экспрессию адипогенных генов. Кроме того, обестатин ингибирует изопротеренол-индуцированный липолиз в 3T3-L1 и адипоцитах SC и OM человека, выделенных как у худых, так и у тучных людей, и предотвращает высвобождение неэтерифицированных жирных кислот (NEFA) в клетках 3T3-L1. Он также индуцирует фосфорилирование АМФ-активированной протеинкиназы (АМФК) в клетках 3T3-L1 и человеческих адипоцитах, активация которых связана с ингибированием липолиза. Недавно было обнаружено, что в коровьей WAT инфузия обестатина снижает уровни экспрессии ABCA1 (АТФ-связывающей кассеты A1), ключевого переносчика холестерина[13].
Как в 3T3-L1, так и в адипоцитах SC человека обестатин способствует транслокации транспортера глюкозы GLUT4 и увеличивает поглощение глюкозы за счет увеличения уровня сиртуина 1 (SIRT1), который функционирует в качестве положительного регулятора транспорта глюкозы и передачи сигналов инсулина в адипоцитах. Однако никакого эффекта обестатина на поглощение глюкозы также не наблюдалось.
В 3T3-L1 и адипоцитах SC человека обестатин также индуцировал фосфорилирование PI3K / Akt и активировал нижестоящие пути Akt, такие как GSK-3β, mTOR и S6K1. Подобные эффекты были также продемонстрированы invivo, в WAT(белая жировая ткань) крыс с инфузией обестатина. Интересно, что обестатин даже стимулировал секрецию адипонектина и ингибировал секрецию лептина invitro, в 3T3-L1, а также invivo, как в эпидидимальной, так и в жировой ткани SC у мышей с HFD. Известно, что адипонектин и лептин играют положительную или отрицательную роль в метаболизме глюкозы, соответственно[13].
Эффекты обестатина на функцию адипоцитов также наблюдались invivo, где пептид снижал резистентность к инсулину и оказывал противовоспалительное действие у мышей, получавших диету с высоким содержанием жира (HFD). Действительно, обестатин предотвращал вызванное HFD повышение уровня глюкозы и способствовал увеличению как инсулина в плазме, так и поджелудочной железы, возможно, из-за его инсулинотропного эффекта и выживаемости в β-клетках. Кроме того, обестатин ингибировал индуцируемое HFD уменьшение площади островков поджелудочной железы и сильно стимулировал индуцируемую глюкозой секрецию инсулина в островках от мышей, которых кормили как диетой с низким содержанием жира (LFD), так и HFD. У мышей, получавших лечение обестатином, эпидидимальный жир показал повышенное поглощение глюкозы, увеличенное количество мелких и, вероятно, чувствительных к инсулину адипоцитов, а также снижение липолиза и апоптоза по сравнению с необработанными животными[14]. Эти результаты свидетельствуют о расширении WAT и усилении защиты от инсулинорезистентности, вызванной диетой.
Наконец, что важно, обестатин уменьшал воспаление у мышей, получавших HFD, путем ингибирования высвобождения провоспалительных цитокинов в жире, мышцах и печени. Хорошо известно, что хроническое воспаление и аномальная продукция цитокинов в WAT тесно связаны с ожирением, резистентностью к инсулину и диабетом 2 типа (T2D); следовательно, эти результаты подтверждают противовоспалительную роль пептида.
Обестатин в физиологической и неопластической клеточной пролиферации
Различные исследования показали, что обестатин играет роль в регуляции клеточного цикла, оказывая пролиферативное воздействие, и это очевидно как в физиологии клетки, так и в онкологии. Чжан и соавт.подчеркивают способность обестатина индуцировать экспрессию генов раннего ответа c-fos и активацию пути ERK и MAPK в желудке, кишечнике, печени и почках с использованием культивируемых преадипоцитов. Механизмы клеточной пролиферации показаны на рис 6,исследователи оценивали влияние обестатина на пролиферацию клеток в первичных культурах пигментных эпителиальных клеток сетчатки человеках[15]. Результаты показали, что этот пептид индуцировал пролиферацию клеток дозозависимым образом с фосфорилированием MEK / ERK 1/2. Обестатин индуцирует ассоциацию сигнального комплекса GPR39 / бета-аррестин 1 / Src, что приводит к трансактивации рецептора эпидермального фактора роста и нисходящей передачи сигналов Akt. Mészárosováetal. исследовали роль обестатина в прямом контроле пролиферации, апоптоза и секреции клеток яичника свиньи. Обестатин усиливает экспрессию нескольких маркеров пролиферации (пептиды PCNA, циклин B1 и MAP киназа), которые участвуют в промотировании митотической фазы клеточного цикла. Обестатин также может ингибировать экспрессию маркеров пролиферации клеток посредством стимуляции р53, известного блокатора клеточного цикла[15]. Граната и соавт. утверждали, что обестатин связывает рецепторы GLP-1 на линиях β-клеток поджелудочной железы и островках человека и индуцирует выживание и пролиферацию β-клеток с помощью механизмов, опосредованных рецептором GLP-1, а также ответных реакций, включая фосфорилирование ERK1 / 2 и Akt. Влияние обестатина на две линии нейроэндокринных опухолевых клеток было исследовано Volanteetal., подчеркивая пролиферативное действие обестатина. Обестатин активирует пролиферацию клеток в клеточной линии рака желудка KATO-III, индуцируя пролиферацию клеток путем фосфорилирования митоген-активируемой киназыкиназы / внеклеточной сигнальной киназы 1/2 (ERK1 / 2). Однако следует отметить, что в литературе есть работы, в которых подчеркивается, что обестатин также обладает антипролиферативным действием. В исследовании Iglesiasetal., обестатин не изменял клеточный цикл или жизнеспособность клеточной линии мышиных кардиомиоцитов HL-1 и не мог предотвратить вызванный цитозинарабинозидом апоптоз кардиомиоцитов HL-1. В работе, проведенной Zhangetal. было продемонстрировано, что обестатин может ингибировать пролиферацию и дифференцировку преадипоцитов 3T3-L1. Участие Обестатина в канцерогенезе было подчеркнуто Alnemaetal., который исследовал иммуногистохимические особенности плоскоклеточного рака полости рта в зависимости от концентрации грелина и обестатина в тканях. Экспрессия грелина и обестатина была снижена или отсутствовала в связи с инвазивностью карциномы с гипотетической ролью этих двух пептидов в координации нормального деления клеток, роста опухоли и метастазирования[16].
Обестатин-стимулированный сигнальный путь при активации ERK 1/2 в клетках. Обестатин активирует PI3K, что приводит к фосфорилированию PKC-ε, которое активирует Src. Последний будет активировать Raf-зависимую активацию ERK 1/2 через Ras или путем прямой активации Raf. После активации ERK 1/2 транслоцируются в ядро, где они фосфорилируют и активируют факторы транскрипции, которые приводят к митогенной активности, способствующей прогрессии G 1>S[17]. PI3K = фосфоинозитид-3-киназа; PKC-ε = протеинкиназа C; Raf = серин / треонинкиназа; ERK = внеклеточный сигнал регулируемых киназ.
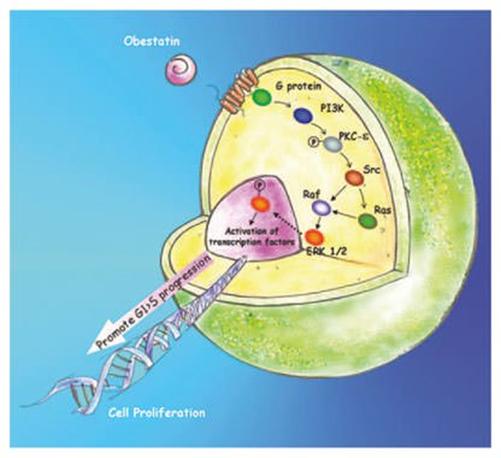
Рис.6 Клеточная пролиферация под действием обестатина