Лекция 9.
Переработку оксидов, полученных окислением NO, в разбавленную кислоту осуществляют путем абсорбции оксидов водой или водным раствором азотной кислоты. Из оксидов азота, образуемых в результате окисления NO, все способны поглощаться водой, кроме самого оксида азота (II) NO. При этом протекают реакции:
 ;
;
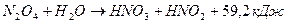 ;
;
 .
.
Оксиды азота NO2 и N2O4 реагируют с водой с образованием эквимолярной смеси азотной и азотистой кислот. Так как оксиды азота NO2 и N2O4 взаимно переходят друг в друга с большой скоростью, то нет большой разницы, какой из них лучше использовать для абсорбции водой.
Азотистая кислота является малоустойчивой и разлагается:
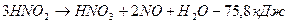 .
.
При обычных условиях равновесное содержание азотистой кислоты в разбавленной азотной кислоте очень мало. Повышение температуры приводит к быстрому увеличению скорости разложения азотистой кислоты, особенно при температуре более 40°С.
Скорость разложения азотистой кислоты выражается уравнением:
 ,
,
где  - парциальное давление NO, МПа;
- парциальное давление NO, МПа;  - время, мин;
- время, мин;  - начальная концентрация HNO2, моль/л;
- начальная концентрация HNO2, моль/л;  - изменение концентрации HNO2, моль/л;
- изменение концентрации HNO2, моль/л; 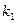 - константа скорости реакции разложения азотистой кислоты.
- константа скорости реакции разложения азотистой кислоты.
Зависимость константы скорости от температуры выражается уравнением:
 .
.
Таким образом, с учетом разложения азотистой кислоты, суммарные реакции поглощения оксидов азота имеют следующий вид:
1. 
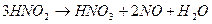
----------------------------------------

2. 
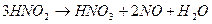
----------------------------------------
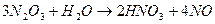
Так как количество оксида азота N2O3 в газе малое, то обычно расчеты процесса абсорбции проводят для газа NO2.
Общая схема получения разбавленной азотной кислоты состоит из стадий:
1. Диффузия оксидов азота из газовой фазы в жидкую.
2. Взаимодействие оксидов азота с водой, с образованием HNO3 и HNO2.
3. Разложение HNO2 с выделением оксида азота NO в газовую фазу.
Лимитирующей стадией из перечисленных является диффузия оксидов азота из газообразной фазы в жидкую.
Некоторые авторы полагают, что образование азотной кислоты может протекать не только в жидкой фазе, но и газообразной, когда оксиды азота взаимодействуют с парами воды.
Равновесие реакции поглощения NO2.
Основной реакцией, определяющей концентрацию получаемой азотной кислоты, является реакция:
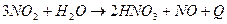 .
.
Данная реакция протекает с выделением тепла (тепловой эффект реакции составляет 73,6 кДж).
Константа равновесия данной реакции имеет следующий вид:
 .
.
Константу равновесия данной реакции целесообразно рассматривать как произведение двух частных констант: 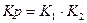 . Где
. Где
 ,
,  .
.
Частные константы К1 и К2 зависят не только от температуры, но и от содержания кислоты в растворе. Для практических целей расчет равновесия реакции удобнее проводить по частному уравнению  . Значения К1 для различных концентраций азотной кислоты по данным Г. Бердика и Е. Фрида представлены на рисунке 1.
. Значения К1 для различных концентраций азотной кислоты по данным Г. Бердика и Е. Фрида представлены на рисунке 1.
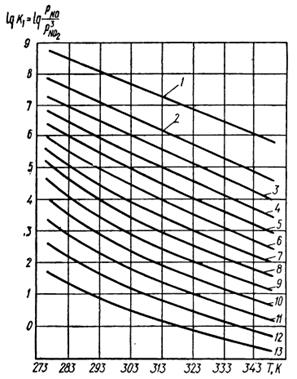
| Рис. 1. Частные константы К1 равновесия реакции поглощения NO2 водным раствором азотной кислоты. Значения сHNO3, %: 1 – 5; 2 – 10; 3 – 15; 4 – 20; 5 – 25; 6 – 30; 7 – 35; 8 – 40; 9 – 45; 10 – 50; 11 – 55; 12 – 60; 13 – 65. |
На рисунке 2 представлена равновесная степень поглощения оксида азота NO2 растворами азотной кислоты при 35°С.
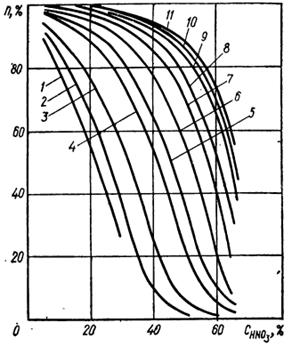
| Рис. 2. Зависимость равновесной степени абсорбции NO2 (n) различной концентрации от концентрации азотной кислоты при 35°С и атмосферном давлении. Значения сNO2, %: 1 – 0,1; 2 – 0,5; 3 – 1; 4 – 3; 5 – 5; 6 – 10; 7 – 20; 8 – 30; 9 – 40; 10 – 50; 11 – 60. |
Из диаграммы следует, что получение азотной кислоты, имеющей концентрацию более 60%, при производственных условиях практически невозможно.
На основании экспериментальных исследований были выведены эмпирические уравнения для определения частной константы К1.
Одно из известных эмпирических уравнений имеет следующий вид:
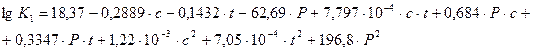
где 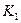 - частная константа, (МПа)-2;
- частная константа, (МПа)-2;  - концентрация азотной кислоты, %;
- концентрация азотной кислоты, %;  - температура, °С;
- температура, °С; 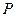 - суммарное парциальное давление оксидов азота (NO+NO2+N2O4), МПа.
- суммарное парциальное давление оксидов азота (NO+NO2+N2O4), МПа.
Данное уравнение справедливо при концентрации азотной кислоты от 30 до 70%, Суммарном парциальном давлении оксидов азота (0,39-9,16)·104 Па, температуре от 20 до 70°С.
При концентрации азотной кислоты менее 30% и Р в диапазоне 0,01-0,02 МПа можно использовать уравнение:
 ,
,
где  - температура в градусах К.
- температура в градусах К.
Данные расчетов, полученные с использованием эмпирических уравнений, подтверждают, что концентрация азотной кислоты не превышает 60-62%. При концентрации кислоты 65-68% процесс кислотообразования практически полностью прекращается при обычных условиях проведения процесса.
Кинетика реакции поглощения NO2.
Кинетика взаимодействия оксидов азота с водными растворами азотной кислоты в присутствии кислорода представляет собой сложный массообменный процесс, сопровождаемый химическими реакциями в газовой и жидкой фазах. Скорость взаимодействия оксидов азота с водой зависит от физико-химических и гидродинамических условий абсорбции. На рисунке 3 представлен график зависимости скорости поглощения NO2 от среднелогарифмической разности парциальных давлений оксидов азота при различной линейной скорости газа.
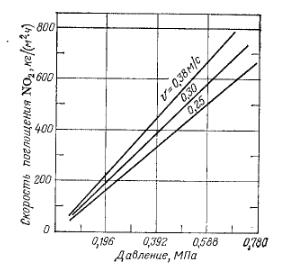
| Рис. 3. Зависимость скорости поглощения NO2 от среднелогарифмической разности парциальных давлений оксидов азота при различной линейной скорости газа. |
Скорость абсорбции нитрозного газа можно описать основным уравнением массопередачи:
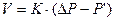 ,
,
где  - скорость поглощения оксидов азота (в пересчете на HNO3), отнесенная к площади сетчатой тарелки, кг/(м3·ч);
- скорость поглощения оксидов азота (в пересчете на HNO3), отнесенная к площади сетчатой тарелки, кг/(м3·ч);  - фактор, учитывающий протекание реакции, и равный 9,807·102 Па;
- фактор, учитывающий протекание реакции, и равный 9,807·102 Па;  - средняя движущая сила процесса, Па;
- средняя движущая сила процесса, Па;  - коэффициент массопередачи.
- коэффициент массопередачи.
Средняя движущая сила процесса определяется следующим образом:
 ,
,
где  - начальное и конечное давление оксидов азота, Па;
- начальное и конечное давление оксидов азота, Па;  - равновесное давление оксидов азота в начале и в конце процесса, Па.
- равновесное давление оксидов азота в начале и в конце процесса, Па.
На рисунке 4 представлен график зависимости степени поглощения оксидов азота от содержания их в газе и степени окисления NO при 0,49 МПа и 35°С. Результаты получены на модели абсорбера с сетчатой тарелкой при диаметре отверстия 1 мм и площадью свободного сечения 3%.

| Рис. 4. Зависимость степени поглощения оксидов азота от содержания их в газе и степени окисления NO при 0,49 МПа и 35°С. |
Скорость и степень абсорбции оксидов азота при снижении их концентрации заметно снижается, что хорошо заметно на графике. Важным фактором, влияющим на интенсивность абсорбции, является степень окисления нитрозного газа, особенно при получении кислоты с концентрацией более 55%.
В зависимости от состава газа и условий переработки наблюдается некоторое оптимальное значение температуры, которое увеличивается по мере возрастания нитрозности газа, давления и равновесной концентрации азотной кислоты.
Эффективность переработки оксидов азота в кислоту во многом зависит от времени контакта фаз, конструктивного оформления процесса, гидродинамических условий. Максимальное влияние на показатели абсорбции оказывают высота перелива, диаметр отверстий и площадь свободного сичения сетчатых тарелок.
В практике расчетов эффективность абсорбционных колон оценивают коэффициентом полезного действия, то есть степенью достижения равновесия между нитрозным газом и раствором кислоты на тарелке. Значение коэффициента полезного действия ситчатой тарелки можно определить при помощи уравнения:
 ,
,
где 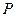 - общее давление газа, МПа;
- общее давление газа, МПа;  - концентрация оксидов азота в пересчете на NO и NO2, % об.;
- концентрация оксидов азота в пересчете на NO и NO2, % об.;  - степень окисления нитрозного газа, доли ед.;
- степень окисления нитрозного газа, доли ед.;  - высота перелива жидкости из тарелки, м;
- высота перелива жидкости из тарелки, м;  - концентрация азотной кислоты, %;
- концентрация азотной кислоты, %;  - скорость газа в полом сечении колонны, м/с;
- скорость газа в полом сечении колонны, м/с;  - диаметр отверстий ситчатой тарелки, м;
- диаметр отверстий ситчатой тарелки, м;  - доля свободного сечения тарелки, доли ед.;
- доля свободного сечения тарелки, доли ед.;  - температура раствора на тарелке, К.
- температура раствора на тарелке, К.
Нитрозный газ перед подачей в колонну следует охлаждать для выделения реакционной воды, с последующим окислением. Выделение реакционной воды в холодильниках-конденсаторах сопровождается кислотообразованием, причем скорость кислотообразования в данном случае выше, чем в абсорбционной колонне. Концентрацию азотной кислоты, образующейся при охлаждении нитрозного газа, можно определить по формуле:
 ,
,
где  - концентрация азотной кислоты в конденсате, %;
- концентрация азотной кислоты в конденсате, %;  - время пребывания газа в конденсаторе, с;
- время пребывания газа в конденсаторе, с;  - конечная температура охлажденного газа, °С.
- конечная температура охлажденного газа, °С.