ЛАБОРАТОРНАЯ РАБОТА № 2. ОПРЕДЕЛЕНИЕ ТЕПЛОВЫХ ЭФФЕКТОВ ПРОЦЕССОВ НЕЙТРАЛИЗАЦИИ, РАСТВОРЕНИЯ, ГИДРАТАЦИИ
Цель работы. Выполнение калориметрических измерений и термодинамических расчётов, связанных с энергетикой химических реакций.
Приборы и реактивы
Для измерения тепловых эффектов различных процессов используют калориметрическую установку (рис. 2). 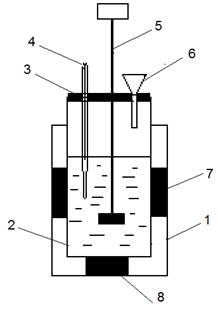 Она состоит из наружного (1) и внутреннего (2) стаканов, пробки (3), термометра (4), мешалки (5) и воронки (6). Во избежание потерь теплоты через стенки внутреннего стакана между сосудами помещают теплоизолирующие прокладки (7) и (8).
Она состоит из наружного (1) и внутреннего (2) стаканов, пробки (3), термометра (4), мешалки (5) и воронки (6). Во избежание потерь теплоты через стенки внутреннего стакана между сосудами помещают теплоизолирующие прокладки (7) и (8).
В опыте используют: весы, мерный цилиндр ёмкостью 50 мл (2 шт.), цилиндр или мензурка ёмкостью 100 мл (1 шт.), шпатели, 1 М растворы HCl, NaOH (50 мл), кристаллические КNO3 и СuSО4.
Порядок выполнения работы
| Рис. 2. Калориметрическая установка |
Опыт 1. Определение теплового эффекта реакции нейтрализации сильной кислоты сильным основанием
1. Взвесьте сухой внутренний калориметрический стакан 2 с точностью до 0,1 г, данные (m1) занесите в таблицу 2.
2. Соберите калориметрическую установку (рис. 2).
3. Отмерьте цилиндром 50 мл 1 М раствора соляной кислоты и через воронку перелейте его во внутренний стакан 2.
4. Закройте калориметрический стакан пробкой 3. Запишите в таблицу 2 температуру раствора кислоты (tк) с точностью до 0,5 0С.
5. В мерный цилиндр налейте 50 мл 1 М раствора гидроксида натрия и измерьте температуру раствора щелочи (tщ) с точностью до 0,5 0С.
6. Запишите в таблицу 2 начальную температуру смеси кислоты и щелочи t1 – среднее арифметическое от tщ и tк.
7. Приоткрыв пробку 3, быстро прилейте раствор NaOH из цилиндра в калориметр, закройте её.
8. Придерживая пробку, аккуратно встряхните калориметр для перемешивания жидкости. Одновременно следите за изменениями температуры. Зафиксируйте максимальное значение температуры t2, которое покажет термометр 4 после сливания растворов.
Обработка результатов эксперимента
1. По полученным данным вычислите количество теплоты (Q, Дж), выделившееся в опыте по формуле (5):
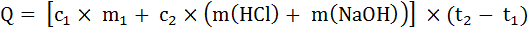 , (5)
, (5)
где с1 – теплоёмкость стекла, равная 0,75 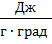 ;
;
с2 – теплоёмкость раствора, равная 4,18 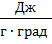 ;
;
m1 – масса калориметрического стакана, г
m(HCl) – масса раствора кислоты, г (плотность 1М HCl ρ=1,018 г/мл);
m(NaOH) – масса раствора щелочи, г (плотность 1М NaOH ρ=1,045 г/мл).
2. Вычислите молярный тепловой эффект реакции нейтрализации (∆Hпракт, 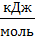 ) по формуле (6) учитывая, что 50 мл 1 М раствора кислоты (щёлочи) содержат 0,050 моль растворенного вещества:
) по формуле (6) учитывая, что 50 мл 1 М раствора кислоты (щёлочи) содержат 0,050 моль растворенного вещества:
∆Hпракт = – 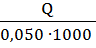 (6)
(6)
3. Сравните полученное значение теплоты нейтрализации с теоретическим значением (∆Hтеорет, 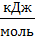 ) (Приложение, табл. 2) и рассчитайте ошибку опыта (η, %) по формуле (7):
) (Приложение, табл. 2) и рассчитайте ошибку опыта (η, %) по формуле (7):
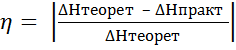
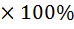 (7)
(7)
4. Использованные и полученные при проведении лабораторной работы величины занесите в таблицу 2.
Таблица 2. Использованные и полученные при проведении лабораторной работы величины
| № | Название | Обозначение | Величина | Единицы измерения |
| Масса раствора кислоты | m(HCl) | г | ||
| Масса раствора щелочи | m(NaOH) | г | ||
| Температура раствора кислоты | tк | 0C | ||
| Температура раствора щелочи | tщ | 0C | ||
| Начальная температура смеси кислоты и щелочи | t1 | 0C | ||
| Конечная температура смеси кислоты и щелочи | t2 | 0C | ||
| Масса калориметрического стакана | m1 | г | ||
| Количество теплоты | Q | Дж | ||
| Тепловой эффект реакции нейтрализации практический | ∆Hпракт | 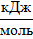
| ||
| Тепловой эффект реакции нейтрализации теоретический | ∆Hтеор | 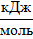
| ||
| Ошибка опыта | η | % |
Опыт 2. Определение теплового эффекта процесса растворения
Нитрата калия в воде
Процесс растворения KNO3 в воде можно представить так:
KNO3 + (n + m) H2O = K+ ∙ n H2O + NO3- ∙ m H2O,
где K+ ∙ n H2O и NO3- ∙ m H2O – гидратированные ионы в растворе.
1. В чистый и сухой стакан калориметра при помощи мерного цилиндра налейте 100 мл дистиллированной воды.
2. Измерьте температуру воды (t1, 0С), данные занесите в таблицу 3.
3. Взвесьте соль (5 г) с точностью до 0,01 г. Данные о массе навески занесите в таблицу 3 (m(KNO3)).
4. Быстро всыпьте соль в воду, закройте калориметр пробкой.
5. Придерживая пробку, встряхните калориметр для растворения соли. Одновременно следите за изменениями температуры. Зафиксируйте минимальное значение температуры t2, которое покажет термометр 4 после полного растворения соли.