Окисление органических веществ в живых тканях растений и животных происходит с участием ферментов: дегидрогеназ – активаторов и переносчиков водорода (электрона) дыхательного материала и оксидаз – активаторов молекулярного кислорода.
Дегидрогеназы (от де... и новолат. hуdrogenium – водород), ферменты, катализирующие отщепление водорода от органических веществ. Коферментами Д. обычно являются динуклеотиды:
- никотинамидадениндинуклеотид (НАД),
- никотинамидадениндинуклеотидфосфат (НАДФ) или флавинадениндинуклеотид (ФАД)
- флавинмононуклеотид (ФМН), которые акцептируют водород окисляемого вещества. Д. осуществляют первый этап биологического окисления.
Они играют большую роль в цикле Кребса, в гликолизе и в пентозофосфатном цикле. Некоторые Д., не связанные с коферментами, катализируют реакции окисления веществ непосредственно кислородом. Большая часть Д. в составе активного центра содержит металлы – цинк, марганец.
Дегидрогеназы действуют на протяжении всего процесса дыхания и по характеру действия делятся на аэробные и анаэробные. Первые переносят водород непосредственно на молекулярный кислород, а вторые – на какой-либо акцептор водорода. Дегидрогеназы относятся к двухкомпонентным ферментам – протеидам с пиридиновыми или флавиновыми (аллоксазиновыми) коферментами.
Пиридиновые дегидрогеназы относятся к группе анаэробных дегидрогеназ, которые являются акцепторами водорода субстрата. Специфичность их действия заключается в способности гидрирования и дегидрирования пиридиновых ядер.
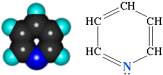
Рис. 1 − Пиридин
К флавопротеидным дегидрогеназам относятся ферменты, в состав которых фосфорный эфир рибофлавина.
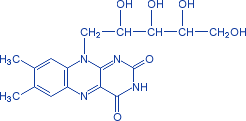
Рис. 2 − Рибофлавин
ЛИТЕРАТУРА
1. Березов Т. Т., Коровкин Б. Ф. Биологическая химия. М.: Медицина, 1990. С. 213–220; 1998. С. 305–317.
2. Николаев А. Я. Биологическая химия. М.: Высшая школа, 1989. С. 199–221.
Дополнительная
3. Филиппович Ю. Б. Основы биохимии. М.: Высшая школа, 1993. С. 403–438.
4. Марри Р. и др. Биохимия человека. М.: Мир, 1993. Т. 1. С. 111–139.
5. Ленинджер А. Основы биохимии. М.: Мир, 1985. Т. 2. С. 403–438, 508–550.
6. АлбертсБ.идр., Молекулярнаябиология клетки. М.: Мир, 1994.Т. 1. С. 430–459.
7. Скулачев В.П. Энергетика биологическихмембран. М.: Наука. 1989.
8. Это процесс потребление клетками тканей организма кислорода, который участвует в биологическом окислении. Такой вид окисления называют аэробным окислением. Если конечным акцептором в цепи переноса водорода выступает не кислород, а другие вещества (например пировиноградная кислота), то такой тип окисления называют анаэробным.
9. Т.о. биологическое окисление - это дегидрирование субстрата с помощью промежуточных переносчиков водорода и его конечного акцептора. Биологическое окисление питательных веществ происходит в митохондриях. В них были обнаружены ферменты, участвующие в цикле лимонной кислоты, дыхательной цепи, окислительного фосфорилирования, в расщеплении жирных кислот и ряда аминокислот.
10. Дыхательная цепь (ферменты тканевого дыхания) - это переносчики протонов и электронов от окисляемого субстрата на кислород. Окислитель - это соединение, способное принимать электроны. Такая способность количественно характеризуется окислительно-восстановительным потенциалом по отношению к стандартному водородному электроду, рН которого равен 7,0. Чем меньше потенциал соединения, тем сильнее его восстанавливающие свойства и наоборот.
11. Особенности тканевого дыхания
12. Процесс тканевого дыхания нельзя считать тождественным процессам биологического окисления (ферментативным процессам окисления различных субстратов, протекающим в животных, растительных и микробных клетках), поскольку значительная часть таких окислительных превращений в организме происходит в анаэробных условиях, т.е. без участия молекулярного кислорода, в отличие от дыхания тканей.
Большая часть энергии в аэробных клетках образуется благодаря дыханию тканей, и количество образующейся энергии зависит от его интенсивности. Интенсивность Д. т. определяется скоростью поглощения кислорода на единицу массы ткани; в норме она обусловлена потребностью ткани в энергии. Интенсивность его наиболее высока в сетчатке глаза, почках, печени; она значительна в слизистой оболочке кишечника, щитовидной железе, яичках, коре головного мозга, гипофизе, селезенке, костном мозге, легких, плаценте, вилочковой железе, поджелудочной железе, диафрагме, сердце, скелетной мышце, находящейся в состоянии покоя. В коже, роговице и хрусталике глаза интенсивность тканевого дыхания невелика. Гормоны щитовидной железы, жирные кислоты и другие биологически активные вещества способны активизировать тканевое дыхание.
Интенсивность такого дыхания определяют полярографически или манометрическим методом в аппарате Варбурга. В последнем случае для характеристики используют так называемый дыхательный коэффициент — отношение объема выделившегося углекислого газа к объему кислорода, поглощенного определенным количеством исследуемой ткани за определенный промежуток времени.
13. Т. о. любое соединение может отдавать электроны только соединению с более высоким окислительно-восстановительным потенциалом. В дыхательной цепи каждое последующее звено имеет более высокий потенциал, чем предыдущее.
14. Дыхательная цепь
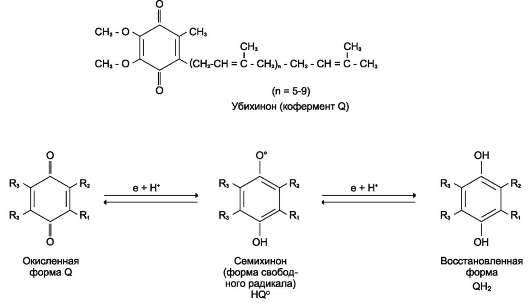
15. Дыхательная цепь состоит из: НАД - зависимой дегидрогеназы; ФАД- зависимой дегидрогеназы; Убихинона (КоQ); Цитохрмов b, c, a+a3.
16. НАД-зависимые дегидрогеназы. В качестве кофермента содержат НАД и НАДФ. Пиридиновое кольцо никотинамида способно присоединять электроны и протоны водорода.
17. ФАД и ФМН-зависимые дегидрогеназы содержат в качестве кофермента фосфорный эфир витамина В2 (ФАД).
18. Убихинон (КоQ) отнимает водород у флавопротеидов и превращается при этом в гидрохинон.
19. Цитохромы - белки хромопротеиды, способные присоединять электроны, благодаря наличию в своем составе в качестве простетических групп железопорфиринов. Они принимают электрон от вещества, являющегося немного боле сильным восстановителем, и передают его более сильному окислителю. Атом железа связан с атомом азота имидазольного кольца аминоксилоты гистидина с одной стороны от плоскости порфиринового цикла, а с другой стороны с атомом серы метионина. Поэтому потенциальная способность атома железа в цитохромах к связыванию кислорода подавлена.
20. В цитохроме с порфириновая плоскость ковалентно связана с белком через два остатка цистеина, а в цитохромах b и а, она ковалентно не связано с белком.
21. В цитохроме а+а3 (цитохромоксидазе) вместо протопорфирина содержатся порфирин А, который отличатся рядом структурных особенностей. Пятое координационное положение железа занято аминогруппой, принадлежащей остатку аминосахара, входящего в состав самого белка.
22. В отличии от гема гемолгобина атом железа в цитохромах может обратимо переходить из двух в трехвалентное состояние это обеспечивает транспорт электронов.
23. Потребности тканей в кислороде и его запасы
Потребности тканей в кислороде зависят от функционального состояния клеток, входящих в ее состав. Скорость потребления кислорода обычно выражается в мл кислорода на 1 г веса в минуту. В состоянии покоя кислород относительно интенсивно поглощается миокардом, серым веществом головного мозга (в частности, корой головного мозга), печенью и корковым веществом почек. В тоже время скелетные мышцы, селезенка и белое вещество головного мозга в покое потребляют мало кислорода.
При увеличении активности какого-либо органа потребность его в кислороде увеличивается. При физической нагрузке потребление кислорода миокардом может увеличиться в 3 - 4 раза, а работающими скелетными мышцами - более чем в 20 - 50 раз по сравнению с покоем. Потребление кислорода почками возрастает при увеличении интенсивности реабсорбции ионов натрия.
Количество кислорода, которое клетки могут использовать для окислительных процессов, зависит от конвекционного переноса кислорода кровью и диффузии кислорода из капилляров в ткани. Поскольку единственным запасом кислорода в большинстве тканей служит его физически растворенная фракция, снижение поступления кислорода приводит к кислородному голоданию и к замедлению окислительных процессов.
Единственной тканью, в которой имеются запасы кислорода, является мышечная ткань. Роль депо кислорода играет пигмент миоглобин, способный обратимо связывать кислород. Однако содержание миоглобина в мышцах человека невелико, так, среднее содержание миоглобина в сердце составляет 4 мг/г. Поскольку 1 г миоглобина может связать примерно до 1,34 мл кислорода, запасы кислорода в сердце составляют около 0,005 мл кислорода на 1г ткани. Этого количества в условиях полного прекращения доставки кислорода к миокарду может хватить для того, чтобы поддерживать окислительные процессы лишь в течение примерно 3 - 4 секунд.
Миоглобин играет роль кратковременного депо кислорода. В миокарде кислород, связанный с миоглобином, обеспечивает окислительные процессы в тех участках, кровоснабжение которых на короткий срок снижается или полностью прекращается во время систолы.
В начальном периоде интенсивной мышечной нагрузки увеличенные потребности скелетных мышц в кислороде частично удовлетворяются за счет кислорода, высвобождающегося миоглобином. В дальнейшем возрастает мышечный кровоток, и поступление кислорода к мышцам вновь становится адекватным. Восполнение запасов оксимиоглобина является составной частью кислородного долга, который должен быть покрыт каждым мышечным волокном после окончания работы.
Кислородное голодание тканей
При ряде патологических состояний страдает снабжение тканей кислородом. В этих случаях энергетические потребности клеток могут в течение короткого времени удовлетворяться за счет ограниченных запасов энергии в виде АТФ и креатинфосфата, а также за счет анаэробного гликолиза. Однако эти источники энергии недостаточны и могут использоваться недолго, так как в анаэробных условиях резко возрастает потребность клеток в глюкозе, поступление которой обычно не может удовлетворять эту потребность, и во-вторых, в процессе гликолиза образуется большое количество лактата, который медленно удаляется из ткани для последующей переработки (например, для расщепления в печени, почках или миокарде, или для синтеза гликогена). При значительном недостатке кислорода содержание лактата в крови постоянно нарастает, что приводит к нереспираторному ацидозу. Когда рН внутриклеточной среды падает ниже уровня оптимальной активности ферментных систем, наступают выраженные нарушения клеточного метаболизма.
Основные причины, приводящие к кислородному голоданию (тканевой гипоксии), это понижение напряжения кислорода в артериальной крови (артериальная гипоксия), уменьшение кислородной емкости крови (анемия) и уменьшение кровоснабжения того или иного органа (ишемия).
NADН-дегидрогеназа содержит несколько центров типа Fe2S2 и Fe4S4. Атомы железа в таких центрах могут принимать и отдавать электроны поочерёдно, переходя в ферро- (Fe2+) и ферри-(Fe3+) состояния. От железо-серных центров электроны переносятся на кофермент Q (убихинон) (рис.).