Термодинамические параметры и величины
Параметры ТДС (термодинамические параметры, ТДП): объем, температура, давление, кол-во частиц и т.д. Совокупность ТДП определяет состояние ТДС.
Существует три признака разделения ТДП: внешние и внутренние, аддитивные и неаддитивные, функции состояния и не функции состояния.
Внешние и внутренние термодинамические параметры
Внешние ТДП полностью определяются внешними по отношению к системе телами. Пример: объем идеального газа – в какую емкость поместим, такой объем и будет.
Внутренние ТДП определяется как внешними телами, так и движением частиц самой системы. Примеры: температура, энергия, давление, поток частиц и др.
Аддитивные и неаддитивные термодинамические параметры
Аддитивные (экстенсивные) ТДП – значение параметра для целого равна сумме значений составляющих частей. Примеры: объем, масса, количество вещества,
энтропия, энтальпия. В состоянии термодинамического равновесия (будет рассмотрено ниже) аддитивные ТДП характеризуют систему в целом.
Неаддитивные (интенсивные) ТДП — значение для целого не равно сумме значений для частей. Примеры: температура, давление, химический потенциал. Неаддитивные параметры могут принимать различные значения в разных точках системы. Например если в разных частях системы различная температура получим поток тепла.
Термодинамические параметры являющиеся и не являющиеся функцией состояния
Функции состояния — это такие ТДП, которые в данном состоянии имеют вполне определенные значения. Например, масса, объем.
Не функции состояния (или функция процесса) — это такие ТДП, которые характеризуют процессы, происходящие в системе. Примеры: работа, кол-во теплоты, теплоемкость (количество теплоты, получаемой или отдаваемой системой при переходе из одного состояния в другое).
Термодинамическое равновесие и стационарное состояние
Определение. Стационарное состояние — это состояние открытой ТДС, при котором ТДП не изменяются со временем на фоне протекающих процессов обмена с внешней средой. Например, протекает постоянный электрический ток.
Стационарное состояние достигается за счет того, что существующие потоки вещества и энергии постоянны по скорости и направлению и взаимно уравновешены.
Определение. Термодинамическое равновесие — это состояние ТДС, при котором отсутствуют макроскопические процессы (ТДП остаются неизменными с течением времени, отсутствуют потоки величин).
Состояние термодинамического равновесия обладает свойством транзитивности: если система A находится в равновесии с системой B, а система B – c С, то система А находится в равновесии с С:
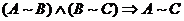
Как определить что две системы находятся в состоянии термодинамического равновесия? Соединить их, если начнется передача энергии или вещества, значит системы не уравновешены. Второй способ – взять пробное тело из одной системы и поместить в другую. Вновь, если начнутся термодинамические процессы, то системы не находятся в термодинамическом равновесии.
«Нулевое начало термодинамики»: любая изолированная ТДС со временем переходит в состояние термодинамического равновесия.
Процесс установления значения ТДП в соответствии с состоянием термодинамического равновесия называется релаксацией. Время, за которое параметр приблизится к равновесному значению в е (2.718) раз называется временем релаксации. Релаксация — физически бесконечно медленный процесс.
Первое начало термодинамики
Определение. Первое начало термодинамики: количество теплоты, переданное системе, идет на изменение внутренней энергии системы и совершаемую ей работу:
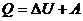
Для малых значений получаемого (отдаваемого) количества теплоты и работы при малых приращениях внутренней энергии, первое начало записывают так:

Работа может совершаться либо за счет сообщенного системе некоторого количества теплоты, либо за счет внутренней энергии.
По существу, это закон сохранения энергии. Он никак не указывает на направление передачи энергии
В отличие от тепловых машин живые организмы производят работу не за счет тепловой энергии, а за счет изменения внутренней энергии при использовании химической энергии пищевых продуктов, усвоенных этими организмами. Поэтому первое начало термодинамики можно записать так:
∆U=Eпищи-Q-A
У человека ΔU=0 (поддерживается постоянная температура), поэтому
Eпищи= = Q +A
Работа A может быть трех видов:
· Синтез, распад — химические процессы.
· Работа против внешних сил.
· Осмос — работа против градиентов концентрации
Виды приема и передачи теплоты будут рассмотрены ниже.