Е.С. Денисова
Методические указания к контрольным работам
по дисциплине «Химия»
Омск 2009
Министерство транспорта Российской Федерации
Федеральное агентство морского и речного транспорта___
Омский институт водного транспорта (филиал) ФГОУ ВПО
«Новосибирская государственная академия водного транспорта»
Кафедра естественнонаучных и общепрофессиональных дисциплин
Е.С. Денисова
Методические указания к контрольным работам
по дисциплине «Химия»
Омск 2009
УДК 378.302.2
ББК 74.58.4
Д 33
Рецензент:
канд. пед. наук, доцент И.Н. Дергачева
Работа одобрена учебно-методическим советом филиала в качестве методических указаний к контрольным работам по дисциплине «Химия» для студентов очного и заочного отделения ОИВТ (филиал) ФГОУ ВПО «НГАВТ».
Денисова, Е.С. Методические указания к контрольным работам по дисциплине «Химия» [Текст]: метод. указания / Е.С. Денисова. – Омск: Омский институт водного транспорта (филиал) ФГОУ ВПО «НГАВТ», 2009. – 60 с.: ил.
Изложена последовательность выполнения контрольной работы по дисциплине «Химия», представляющая собой решение широкого набора задач, охватывающих разделы курса. Каждый раздел начинается с краткого теоретического введения и примеров с детальным разбором решения задач.
Настоящие методические указания предназначены для студентов очного и заочного отделения ОИВТ (филиал) ФГОУ ВПО «НГАВТ».
© Е.С. Денисова, 2009
© ОИВТ (филиал) ФГОУ ВПО НГАВТ, 2009
Содержание
| Введение………………………………………………………………………….4 1. Строение атома……………………………………………………………..…5 2. Периодическая система элементов Д.И. Менделеева………………...…….8 3. Химическая связь………………………………………………………..……8 4. Основные классы неорганических соединений…………………………….16 5. Способы выражения концентрации растворов………………………..……20 6. Свойства растворов неэлектролитов……………………………………..…24 7. Коллоидные растворы……………………………………………………..…27 8. Энергетика химических реакций. Химико-термодинамические расчеты…………………………………………………………………………..29 9. Скорость химических реакцийи равновесие ……………………………...33 10. Молекулярно-ионные уравнения обменных реакций между растворами электролитов……………………………………………………….37 11. Гидролиз солей……………………………………………………………...39 12. Окислительно-восстановительные реакции………………………….41 13. Гальванические элементы………………………………………………….45 14. Электролиз……………………………………………………………….....48 Библиографический список………………………………………………..…..51 Варианты контрольных заданий…………………………………………..…..52 Приложения…………………………………………………………….……….57 |
ВВеДЕНИЕ
Одной из основных задач методики обучения в высшей школе является разработка наиболее эффективных методов обучения и контроля знаний. Основная цель контрольных работ – закрепление знаний, анализ и контроль освоения студентом программного материала. Изучение курса должно обязательно сопровождаться выполнением упражнений и решением задач. Решение задач – один из лучших методов прочного усвоения, проверки и закрепления теоретического материала.
В процессе изучения курса химии студент должен выполнить контрольную работу, которая включает в себя решение задач, изложенных в данном методическом указании. Задачи расположены в логической последовательности изложения курса. Каждому разделу предпослано краткое теоретическое введение и примеры с детальным разбором хода решения типовых задач.
Контрольная работа должна быть аккуратно оформлена; выполнена в отдельной тетради; каждая задача решается на отдельном листе с указанием темы задания, номера задачи и составленного полного условия задачи; для замечаний рецензента надо оставлять широкие поля. При решении расчетных задач необходимо приводить уравнения реакций, математическое выражение законов и правил (формулы), числовые значения констант. Необходимо указывать весь ход решения задач и все математические преобразования. Работы должны быть датированы, подписаны студентом и представлены в академию на рецензирование. Если задача не зачтена, ее нужно выполнить вторично с учетом замечаний; исправления следует выполнять в конце тетради.
Каждый студент выполняет вариант заданий, обозначенный двумя последними цифрами номера студенческого билета (шифра). Таблица вариантов контрольных заданий приведена в конце пособия. Контрольная работа, выполненная не по своему варианту, преподавателем не рецензируется и не засчитывается как сданная.
Пособие предназначено для студентов всех форм обучения.
Строение атома
Пример 1. Составьте электронные формулы атомов элементов азота и мышьяка. Покажите распределение этих атомов по квантовым (энергетическим) ячейкам в стабильном и возбужденном состояниях.
Решение. В соответствии с правилами заполнения атомных орбиталей последовательность заполнения энергетических уровней и подуровней следующая:
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→(5d1)→4f→5d→6p→7s→(6d1-2)→5f→6d→7p
Максимальное число электронов, которое может разместиться на s- орбитали равно 2, на p -орбитали равно 6, на d -орбитали - 10 и на f- орбитали - 14.
Так как число электронов в атоме элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для азота электронная форма имеет вид
7N 
Электронная структура атома может быть изображена также в виде схем размещения электронов в квантовых (энергетических) ячейках, которые являются схематичным изображением атомных орбиталей. Квантовую ячейку обозначают в виде прямоугольника, а электроны в этих ячейках обозначают стрелками. В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами. Орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами:

Для мышьяка электронная форма имеет вид
33As 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3 4d0
|
 |  | ||||
 | |||||
Валентность равна трем
В возбужденном состоянии:
 |
Валентность равна пяти
Пример 2. Изотоп менделевия (256) был получен бомбардировкой  - частицами ядер атомов эйнштейния (253).
- частицами ядер атомов эйнштейния (253).
 Es +
Es +  He =
He =  Md
Md
Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
Решение. Превращение атомных ядер обуславливается их взаимодействием с элементарными частицами или друг с другом. Ядерные реакции связаны с изменением состава ядер атомов химических элементов. С помощью ядерных реакций можно из атомов одних элементов получить атомы других.
Превращение атомных ядер, как при естественной, так и при искусственной радиоактивности записывают в виде уравнений ядерных реакций. При этом следует помнить, что суммы массовых чисел (цифры, стоящие у символа элемента вверху слева) и алгебраические суммы зарядов (цифры, стоящие у символа элемента внизу слева) частиц в левой и правой частях равенства должны быть равны. Заряд ядра элементов находим по порядковому номеру элементов в периодической системе Д.И. Менделеева. Данную ядерную реакцию выражают уравнением
 Es +
Es +  He =
He = 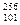 Md +
Md +  n
n
Сокращенная форма записи имеет вид: 253Es ( , n) 256Md. В скобках пишут бомбардирующую частицу, а через запятую – частицу, образующуюся при данном процессе. В сокращенных уравнениях частицы
, n) 256Md. В скобках пишут бомбардирующую частицу, а через запятую – частицу, образующуюся при данном процессе. В сокращенных уравнениях частицы  He;
He;  H;
H;  D;
D;  n;
n; 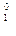 β+;
β+; 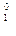 β - обозначают соответственно
β - обозначают соответственно  , p, n, d, β+, β -
, p, n, d, β+, β -
Задание: составьте электронные формулы атомов элементов. Покажите распределение этих атомов по квантовым (энергетическим) ячейкам в стабильном и возбужденном состояниях.
| № задания | Элементы | № задания | Элементы |
| Ba, B Al, Sr Ge, Se Pb, Mg Sb, Cd Co, Sr Mo, Sb, Ca, Pb In, Be Th, K | Ga, Bi Si, Ra Sn, Cl Be, Pb S, I Te, Ac Cr, Fe Ag, Se Na, Re B, Mn |
Задание: записать уравнения ядерных реакций в полной и сокращенной формах
| № задания | |
253Es +    Md Md
| |
45Ti 
| |
51V [  ; n]? ; n]?
| |
55Mn [?;  ] ]  V V
| |
? [  ; d] 34Cl ; d] 34Cl
| |
| 56Fe [d;?]57Co | |
 210Po 210Po 
| |
14N + р  11C 11C
| |
239 Pu 
| |
27Al +  30 Si 30 Si
| |
86 Rb 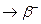
| |
 Fe + n Fe + n  Mn Mn
| |
 Al + Al +  H = H =  Mg Mg
| |
 Be + Be +  He = He =  n n
| |
 Co + Co +  n = n =  Mn Mn
| |
 N + N +  n = n =  C C
| |
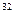 S + S +  D = D =  P P
| |
| 9 Be(a,?)12 C | |
27Al(?,  )24 Mg )24 Mg
| |
32S(d,  )? )?
|
Периодическая система элементов
Д.И. Менделеева
Пример 1. Какую высшую и низшую степени окисления проявляют мышьяк, селен и бром? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
Решение. Высшую степень окисления элемента определяет, как правило, номер группы периодической системы Д.И. Менделеева, в которой он находится. Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того числа электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (ns2, пр6), поэтому ее можно вычислить, отняв от номера группы периодической системы, в которой находится элемент, цифру восемь.
| Элемент | Степень окисления | Соединения | |
| высшая | низшая | ||
| As Se Br | +5 +6 +7 | -3 -2 -1 | H3As04; H3As SeO3; Na2Se НВгО4; КВг |
Задание: Какую высшую и низшую степени окисления проявляют данные элементы? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
| № задания | Эле-мент | № задания | Эле-мент | № задания | Эле-мент | № задания | Эле-мент |
| С N S О Cl | Р Cr Mn Те I | S Cr С N I | S Р О Cl Mn |
Химическая связь
Ковалентная связь - химическая связь, возникающая за счет образования общей пары электронов. Необходимое условие - наличие неспаренных электронов у обоих связываемых атомов (обменный механизм) или неподеленной пары у одного атома и свободной орбитали у другого (донорно-акцепторный механизм):
| а) | H· + ·H  H:H H:H
| H-H | H2 | (одна общая пара электронов; H одновалентен); |
| б) | 
| N  N N
| N2 | (три общие пары электронов; N трехвалентен); |
| в) | 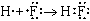
| H-F | HF | (одна общая пара электронов; H и F одновалентны); |
| г) | 
| 
| NH4+ | (четыре общих пары электронов; N четырехвалентен) |