Протекание окислительно-восстановительных реакцийсвязано с изменением степени окисления элементов вследствие смещения или полного перехода электронов отодних атомов или ионов к другим.
Для определения степеней окисления следует руководствоваться следующими правилами:
1. Степень окисления атомов в простых веществах принимается равной нулю.
2. В нейтральных молекулах алгебраическая сумма степеней окисления всех атомов, входящих в их состав, равна нулю, для ионов эта сумма равна заряду иона.
3. Степень окисления щелочных металлов в соединениях всегда равна +1, а щелочноземельных +2.
4. Водород во всех соединениях, кроме гидридов металлов ( и др.), имеет степень окисления +1; в гидридах металлов степень окисления водорода равна -1.
и др.), имеет степень окисления +1; в гидридах металлов степень окисления водорода равна -1.
5. Кислород в большинстве соединений имеет степень окисления -2 исключения составляют фторид кислорода  , гдестепень окисления кислорода +2, пероксиды, где степень окисления кислорода -1, и некоторые другие вещества (супероксиды, озониды).
, гдестепень окисления кислорода +2, пероксиды, где степень окисления кислорода -1, и некоторые другие вещества (супероксиды, озониды).
Применяя изложенные выше правила, можно вычислить неизвестные степени окисления элементов в сложных соединениях. Например, в соединении  степень окисления марганца равна (
степень окисления марганца равна (
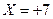 ).
).
Окисление (о-е) это процесс отдачи электронов атомом, молекулой или ионом. При окислении степень окисления увеличивается. Например:
Са – 2е → Са2+; Н2 – 2е → 2Н+; Sn+2 – 2e → Sn+2;
Восстановление (в-е) - процесс присоединения электронов атомом, молекулой или ионом. При восстановлении степень окисления уменьшается. Например:
Se + 2e → Se2–; Br2 + 2e → 2Br–; Sn+4 + 2e → Sn+2
Вещества (атомы, молекулы или ионы), отдающие электроны, называются восстановителями (в-ль); вещества, присоединяющие электроны – окислителями (о-ль). В ходе окислительно-восстановительной реакции восстановитель окисляется, а окислитель восстанавливается.
Для составления уравнений окислительно-восстановительных реакций наиболее часто используют метод электронно-ионных полуреакций и метод электронного баланса.
Метод электронного баланса, основанный на учете изменения степени окисления и принципе электронейтральности молекулы, является универсальным. Его обычно используют для составления уравнений окислительно-восстановительных реакций, протекающих между газами, твердыми веществами и в расплавах.
Последовательность операций, согласно методу, такая:
1) записывают формулы реагентов и продуктов реакции в молекулярном виде:

2) определяют степени окисления атомов, меняющих ее в процессе реакции:

3) по изменению степеней окисления устанавливают число электронов, отдаваемых восстановителем, и число электронов, принимаемых окислителем, и составляют электронный баланс с учетом принципа равенства числа отдаваемых и принимаемых электронов:

4) множители электронного баланса записывают в уравнение окислительно-восстановительной реакции как основные стехиометрические коэффициенты:

5) подбирают стехиометрические коэффициенты остальных участников реакции:

Метод электронно-ионных полуреакций применяют при составлении уравнений реакции, протекающих в водном растворе, а также реакции с участием веществ, степень окисления элементов которых трудно определить (например, KNCS, CH3CH2OH).
В молекулярной схеме реакции определяем изменение степени окисления, находим окислитель и восстановитель:

в-ль о-ль среда
Составляем электронно-ионные полуреакции сначала для процесса окисления, а затем для процесса восстановления, учитывая закон сохранения массы и заряда и правила стяжения:
 3 SO32– + H2O – 2e ® SO42– + 2Н+ o-e, в-ль
3 SO32– + H2O – 2e ® SO42– + 2Н+ o-e, в-ль
2 МnО4– + 2H2O + 3е ® МnO2 + 4OH- в-е, о-ль
Умножаем на полученные множители обе полуреакции и суммируем:
3 SO32– + 2 МnО4– + 7 H2O ® 3 SO42– + 2 МnO2 + 8 OH– + 6 Н+.
После преобразования ионное уравнение реакции будет иметь следующий вид:
3 SO32– + 2 МnО4– + H2O → 3 SO42– + 2 МnO2 + 2 OH–.
В молекулярной форме это уравнение запишется следующим образом:
3 Na2SO4 + 2 КМnО4 + H2O = 3 Na2SO4 + 2 МnО2 + 2 КОH.
2.  .
.
 2 CrO2– + 4OH– – 3e ® CrO42– + H2O о-е; в-ль
2 CrO2– + 4OH– – 3e ® CrO42– + H2O о-е; в-ль
3 H2O2 + 2e ® 2 OH– в-е, о-ль
Для перехода CrO2– в ион CrO42– необходим кислород, который в щелочной среде выделяется из гидроксид-ионов (2ОН– → О2– + Н2О). Восстановление H2O2 в щелочной среде идет с образованием ионов OH–.
Умножаем на полученные множители обе полуреакции и суммируем:
2CrO2– + 3H2O2 + 8OH– ® 2CrO42– + 4H2O + 6OH–.
После преобразования ионное уравнение реакции следующее:
2 CrO2– + 3 H2O2 + 2 OH– → 2 CrO42– + 4 H2O.
На основе ионного уравнения запишем уравнение реакции в молекулярной форме:
2 NaCrO2 + 3 H2O2 + 2 KOH ® Na2CrO4 + K2CrO4 + 4 H2O.
Задание: определить восстановитель и окислитель, расставить коэффициенты
| № задачи | Уравнение окислительно-востановительной реакции |
| S + KOH ® K2SO3 + K2S + H2O H3PO3 + AgNO3 + H2O ® H3PO4 + Ag + HNO3 | |
| NaBrO3 + NaBr + H2SO4 ® Br2 + Na2SO4 + H2O MnO2 + KClO3 + KOH ® K2MnO4 + KCl + H2O | |
| NaHSO3 + Cl2 + H2O ® NaHSO4 + HCl Cr(OH)3 + Br2 + KOH ® K2CrO4 + KBr +H2O | |
| P + HNO3 + H2O ® H3PO4 +NO H2O2 + KMnO4 + KOH ® O2 + K2MnO4 + H2O | |
| HNO2 + Br2 + H2O ® HNO3 + HBr MnSO4 + NaBiO3 + HNO3 ® HMnO4 + Na2SO4 + Bi(NO3)3 + Н2О | |
| Se + HNO3 + H2O ® H2SeO3 + NO Cr2(SO4)3 + Br2 + KOH ® K2CrO4 + KBr + K2SO4 + H2O | |
| Cr2(SO4)3 + H2O2 + KOH ® K2CrO4 + K2SO4 + H2O Hg + NaNO3 + H2SO4 ® Na2SO4 + Hg2SO4 + NO +H2O | |
| Na2SO3 + KMnO4 + H2O ® MnO2 + Na2SO4 + KOH Mn(NO3)2 + PbO2 + HNO3 ® HMnO4 + Pb(NO3)2 + H2O | |
| Na2SO3 + K2Cr2O7 + H2SO4 ® Na2SO4 + Cr2(SO4)3 + K2SO4 + H2O Br2 + NaOH ® NaBrO3 + NaBr + H2O | |
| Ca(ClO)2 + NaBr + H2O ® CaCl2 + Br2 + NaOH Na2SeO3 + F2 + NaOH ® Na2SeO4 +NaF + H2O | |
| PH3 + KMnO4 + H2SO4 ® H3PO4 + MnSO4 + K2SO4 +H2O K2S + NaOCl + H2SO4 ® S + K2SO4 + NaCl + H2O | |
| KI + KIO3 + H2SO4 ® I2 + K2SO4 + H2O MnCl + KBrO + KOH ® MnO2 + KBr + KCl + H2O | |
| CrCl3 + Br2 + KOH ® K2CrO4 + KBr + KCl + H2O FeS2 + HNO3 ® Fe(NO3)3 + NO + H2SO4 + H2O | |
| NaCrO2 + H2O2 + NaOH ® Na2CrO4 + H2O Co(OH)2 + O2 + H2O ® Co(OH)3 | |
| PH3 + KClO3 + KOH ® KCl + K3PO4 + H2O KNO3 + Na2Cr2O7 + HCl ® KNO3 + CrCl3 + NaCl + H2O | |
| Ni(OH)2 + Br2 + H2O ® Ni(OH)3 + HBr K4[Fe(CN)6] + Br2 ® K3[Fe(CN)6] + KBr | |
| NaOCl + KI + H2SO4 ® NaCl + I2 + K2SO4 + H2O Na3CrO3 + PbO2 + NaOH ® Na 2CrO4 + Na2PbO2 + H2O | |
| Fe2(SO4)3 + KI ® I2 + FeSO4 + K2SO4 SO2 + K2Cr2O7 + H2SO4 ® K2SO4 + Cr2(SO4)3 + H2O | |
| Al + K2Cr2O7 + H2SO4 ® Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O HIO3 + H2O2 ® I2 + O2 + H2O | |
| Fe(OH)2 + O2 + H2O ® Fe(OH)3 Sb2O3 + Cl2 + KOH ® KSbO3 + KCl + H2O |
Гальванические элементы
Гальванический элемент - это устройство, в котором, в результате протекания окислительно-восстановительной реакции, возникает электрический ток. Любой гальванический элемент состоит из двух электродов - проводников электрического тока (обычно металлов), погруженных в растворы электролитов и соединенных между собой. Электрод, на котором проходит процесс окисления (отдача электронов), называется анодом; электрод, на котором осуществляется восстановление (присоединение электронов) – катодом
В основе работы гальванических элементов лежат явления, происходящие на границе между металлом и раствором электролита и сопровождающиеся возникновением на ней разности или скачка потенциалов. Разности или скачки потенциалов на границе металл-раствор зависят от активности катионов металла в растворе или, другими словами, каждой данной активности катионов металла в растворе соответствует определенное значение равновесного скачка потенциалов. Они называются электродными потенциалами, а их значения определяются относительно стандартного водородного электрода, принятого в качестве эталона, потенциал которого, называемый стандартным или нормальным, условно принимается равным нулю.
Всякий гальванический элемент состоит из двух электродов – металлов, погруженных в растворы электролитов; последние сообщаются друг с другом – обычно через пористую перегородку. Электрод, на котором в ходе реакции происходит процесс окисления, называется анодом; электрод, на котором осуществляется восстановление, – катодом.
При схематическом изображении гальванического элемента граница раздела между металлом и раствором обозначается вертикальной чертой, граница между растворами электролитов – двойной вертикальной чертой: Zn|Zn(NO3)2 ||AgNO3|Ag.
Максимальное напряжение гальванического элемента, отвечающее обратимому протеканию происходящей в нем реакции, называется электродвижущей силой Е (э.д.с.) элемента.
Если реакция осуществляется в стандартных условиях, т.е., если все вещества, участвующие в реакции, находятся в своих стандартных состояниях, то наблюдаемая при этом э.д.с. называется стандартной электродвижущей силой Ео данного элемента.
Э.д.с. гальванического элемента может быть представлена как разность двух электродных потенциалов φ, каждый из которых отвечает полуреакции, протекающей на одном из электродов:
Е = φAg – φZn.
Здесь φAg и φZn – потенциалы, отвечающие электродным процессам, происходящим соответственно на серебряном и цинковом электродах.
Таблица 2
Электрохимический ряд напряжений металлов
(стандартные электродные потенциалы)
| Металл | Е0, В | Металл | Е0, В |
| Li+/Li | -3,045 | Ga3+/Ga | -0,560 |
| Rb+/Rb | -2,925 | Fe2+/Fe | -0,441 |
| K+/K | -2,924 | Cd2+/Cd | -0,404 |
| Cs+/Cs | -2,923 | In3+/In | -0,338 |
| Ra2+/Ra | -2,916 | Co2+/Co | -0,277 |
| Ba2+/Ba | -2,905 | Ni2+/Ni | -0,234 |
| Sr2+/Sr | -2,888 | Sn2+/Sn | -0,141 |
| Ca2+/Ca | -2,864 | Pb2+/Pb | -0,126 |
| Na+/Na | -2,711 | H+/H2 | ±0,000 |
| Ac3+/Ac | -2,600 | Sb3+/Sb | +0,240 |
| La3+/La | -2,522 | Re3+/Re | +0,300 |
| Y3+/Y | -2,372 | Bi3+/Bi | +0,317 |
| Mg2+/Mg | -2,370 | Cu2+/Cu | +0,338 |
| Sc3+/Sc | -2,077 | Ru2+/Ru | +0,450 |
| Be2+/Be | -1,847 | Ag+/Ag | +0,799 |
| Al3+/Al | -1,700 | Rh3+/Rh | +0,800 |
| Ti3+/Ti | -1,208 | Hg2+/Hg | +0,852 |
| Mn2+/Mn | -1,192 | Pd2+/Pd | +0,915 |
| Cr2+/Cr | -0,852 | Pt2+/Pt | +0,963 |
| Zn2+/Zn | -0,763 | Au+/Au | +1,691 |
Пример 1. Составить схему, написать уравнения электродных процессов и рассчитать э.д.с. элемента, состоящего из цинковой и никелевой пластин, опущенных в растворы сернокислых солей с концентрацией  = 0,01 моль/л.
= 0,01 моль/л.
Решение. В ряду напряжений Zn стоит левее Ni, поэтому в гальваническом элементе отрицательным (анодом) будет цинковый электрод, а положительным (катодом) - никелевый.
Схема гальванического элемента
(-) Zn½ZnSO4½½NiSO4½Ni (+).
При работе элемента протекают реакции:
на аноде Zn ® Zn2+ + 2e,
на катоде Ni2+ + 2e ® Ni.

Электродные потенциалы необходимо вычислить по уравнению Нернста:
 .
. 

Отсюда Е = -0,309 - (-0,819) = 0,51 В.
С учетом того, что число электронов, переносимых во время электрохимической реакции металлами, одинаково и концентрации растворов равны, уравнение упрощается и принимает вид
 ;
;  ;
;
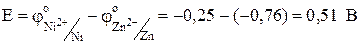 .
.
Гальванический элемент может быть составлен не только из различных, но и из одинаковых электродов, погруженных в растворы одного и того же электролита, различающиеся только концентрацией (концентрационные гальванические элементы). Э.д.с. такого элемента также равна разности потенциалов составляющих его электродов.
Электрод, погруженный в более концентрированный раствор, положителен по отношению к другому, который погружен в более разбавленный раствор.
Задание: составить схему, написать уравнения электродных процессов и рассчитать э.д.с. элемента
| № задачи | 1-й полуэлемент | 2-й полуэлемент |
| Mg; MgSO4 (C1=0,1 моль/л) | Fe; FeSO4 (C2=0,01 моль/л) | |
| Cd; CdSO4 (C1=0,01 моль/л) | Cd; CdSO4 (C2=0,1 моль/л) | |
| Pt, H2; H2SO4 (C1=1 моль/л) | Ag; AgNO3 (C2=0,1 моль/л) | |
| Al; AlCl3 (C1=0,1 моль/л) | Pt, H2; HCl (C2=1 моль/л) | |
| Pb; Pb(NO3)2 (C1=0,01 моль/л) | Cu; Cu(NO3)2 (C2=1 моль/л) | |
| Fe; Fe(NO3)2 (C1=1 моль/л) | Pb; Pb(NO3)2 (C2=1 моль/л) | |
| Ag; AgNO3 (C1=0,1 моль/л) | Ag; AgNO3 (C2=1 моль/л) | |
| Zn; ZnSO4 (C1=0,1 моль/л) | Cu; CuSO4 (C2=0,001 моль/л) | |
| Ni; NiSO4 (C1=0,001 моль/л) | Cu; CuSO4 (C2=0,01 моль/л) | |
| Cd; CdCl2 (C1=1 моль/л) | Sn; SnCl2 (C2=0,01 моль/л) | |
| Zn; ZnSO4 (C1=1 моль/л) | Pt, H2; H2SO4 (C2=1 моль/л) | |
| Fe; FeCl2 (C1=0,1 моль/л) | Ag; AgCl (C2=0,01 моль/л) | |
| Fe; FeCl2 (C1=1 моль/л) | Sn; SnCl2 (C2=1 моль/л) | |
| Mg; Mg(NO3)2 (C1=0,01 моль/л) | Pb; Pb(NO3)2 (C2=0,01 моль/л) | |
| Cu; CuCrO4 (C1=0,01 моль/л) | Cu; CuCrO4 (C2=0,1 моль/л) | |
| Cd; CdCl2 (C1=0,1 моль/л) | Pb; PbCl2 (C2=0,1 моль/л) | |
| Cu; CuCl2 (C1=0,1 моль/л) | Pt, Cl2; 2Cl– (C2=1 моль/л) | |
| Cr; CrSO4 (C1=0,001 моль/л) | Ni; NiSO4 (C2=0,01 моль/л) | |
| Pt, H2; H2SO4 (C1=0,1 моль/л) | Ag; AgI (C2=0,01 моль/л) | |
| Zn; ZnCl2 (C1=1 моль/л) | Cr; CrCl3 (C2=0,1 моль/л) |
Электролиз
Электролиз – это совокупность процессов, протекающих в растворе или расплаве электролита, при пропускании через него электрического тока.
При электролизе растворов солей необходимо помнить правила:
1. Катионы металлов, имеющих малую величину стандартного электродного потенциала (от Li+ до AI3+ включительно), не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды:
2H2O +2e ® H2 + 2OH–.
2. Катионы металлов, имеющих стандартный электродный потенциал меньший, чем у водорода, но больший, чем у алюминия (от AI до H2) при электролизе восстанавливаются одновременно с молекулами воды. Причиной этого явления служит более высокая концентрация катионов металла в растворах по сравнению с ионами водорода ( = 10–7моль/л), а также явление перенапряжения.
= 10–7моль/л), а также явление перенапряжения.
3. Катионы металлов, имеющих стандартный электродный потенциал больший, чем у водорода (от Sb3+ + до Аu+), при электролизе практически полностью восстанавливаются на катоде.
4. На нерастворимом аноде в процессе электролиза происходит окисление анионов или молекул воды. При этом анионы бескислородных кислот (S2-, I-,Вг-, С1-) при их достаточной концентрации легко окисляются. Если же раствор содержит анионы кислородных кислот (например, SO42–, NO3–, СО3 2–, PO43–), то на аноде окисляются не эти ионы, а молекулы воды:
2H2O + 4e ® O2 + 4H+.
Задание: разобрать процессы, протекающие у электродов при электролизе водных растворов: CuCl2, K2SO4, Cd(NO3)2, KBr для каждого из них составить общее уравнение реакции.
Решение. 1. Электролиз водного раствора CuCl2.
Медь в ряду напряжений расположена после водорода; поэтому у катода будет происходить разряд ионов Cu2+ и выделение металлической меди. У анода будут разряжаться хлорид-ионы.
Схема электролиза раствора хлорида мели (II):
CuCl2
Катод ← Cu2+ 2Cl- → Анод
Cu2+ + 2e- =Cu 2Cl- - 2e =Cl2 -
CuCl2 → Cu + Cl2
2. Электролиз водного раствора K2SO4.
Поскольку калий в ряду напряжений стоит значительно раньше водорода, то у катода будет происходить выделение водорода и накопление ОН-. У анода будет идти выделение кислорода и накопление ионов Н+.
Схема электролиза раствора сульфата калия:
K2SO4
Катод ← 2K+ SO42- → Анод
2Н2О + 2е- =2ОН- + H2↑ 2H2O – 4e → O2 + 4H+
2К2SO4 + 6H2O → 2H2↑ + 4КOH + O2↑ + 2H2SO4.
3. Электролиз водного раствора Cd(NO3)2.
При электролизе водных растворов солей цинка, железа, кадмия и некоторых других металлов, стоящих в ряду напряжения, хотя и левее водорода, но близко к нему, на катоде выделяются эти металлы. Объясняется это тем, что процесс разрядки ионов Н+ осложняется адсорбцией атомов и молекул водорода на поверхности электродов. Для того чтобы десорбировать водород и получить его в газообразном состоянии, необходимо приложить избыточную э.д.с. Увеличение э.д.с. приводит к тому, что на катоде происходит выделение металла, стоящего в ряду напряжения левее водорода.
Схема электролиза:
Cd(NO3)2
Катод ← Cd2+ 2NO3- → Анод
Cd2+ + 2e ↔ Cd 2H2O – 4e → O2 + 4H+
2Cd(NO3)2 + 2H2O → 2Cd + O2↑ + 4HNO3.
4. Электролиз водного раствора КВr.
На катоде происходит восстановление воды, а на аноде – окисление брома.
Схема электролиза:
КВr
Катод ← К+ Вr- → Анод
2H2O + 2e → H2 + 2OH– 2Br– – 2e = Br2
2КВr + 2H2O → 2H2 +2КOH + Br2
Задание: разобрать процессы, протекающие у электродов при электролизе водных растворов веществ, для каждого из них составить общее уравнение реакции
| № задачи | Вещества |
| ZnSO4, NaCl, SnCl2, KNO3 | |
| МgJ2, SnCl4, SrCI2, SnBr2 | |
| Pb(NO3)2, CuSO4, HgCI2, KBr | |
| K2SO3, NiSO4, CuJ2, MgCl2 | |
| Na2CrO4, SnSO4, HgCl2, BaBr2 | |
| FeCl3, MgSO4, Cd(NO3)2, CaJ2 | |
| Ca(NO3)2, PdCl2, CoSO4, LiCl | |
| Sr(NO3)2, Cr2(SO4)3, AuCl3, RbCl | |
| BaCl2, FeSO4, K3PO4, ZnJ2 | |
| Sn(NO3)2, CaSO4, СоBr2, KMnО4 | |
| BiCl3, BaCO3, ZnS, MgCO3 | |
| MgCl2, RbClO4, NaNO3, HgS | |
| KClO4, AICI3, Pd(NO3)2, NiCI2 | |
| PbSO4, CuS, Hg2(NO3)2, AgJ | |
| KJ, CaSO4, KNO3, BaSO4 | |
| Ag3PO4, NiSO3, FeS, CdCrO4 | |
| MgCl2, AuCl3, LiCl, ZnBr2 | |
| Ni(NO3)2, KCl, PtCl2, Co(NO3)2 | |
| СuJ2, Fe2(SO4)3, CaJ2, ZnBr2 | |
| Zn(NO3)2, RbCI, ZnBr2, BaCl2 |