Dнанопринтеры в тканевой инженерии
Трехмерная (3D) печать пробивает дорогу ключевым инновациям во многих сферах, таких как инженерное дело, промышленность, искусство, образование и медицина. Последние достижения науки позволили осуществлять 3D-печать биосовместимых материалов, клеток и их вспомогательных компонентов с дальнейшим созданием на их основе полнофункциональных живых тканей. 3D-биопечать можно использовать в регенеративной медицине для трансплантации необходимых тканей и органов.
По сравнению с 3D-печатью из неорганических материалов, в биопечати существуют усложняющие процесс факторы: такие как выбор материалов, типов клеток, факторы их роста и дифференцировки, а также технические сложности, связанные с сенситивностью клеток и формированием тканей.
История развития
Метод 3D-печати был впервые описан в 1986 году Чарльзом В. Халлом. По его методу, названному «стереолитографией», тонкие слои материала, затвердевая под действием ультрафиолетовых лучей, последовательно формируют слои твердой трехмерной структуры. Позднее этот метод стал использоваться для создания композитных форм для культивирования клеток на трехмерных подложках-носителях, так называемых «скаффлодов», из биологических материалов. Развитие систем на водной основе, не содержащих растворителей, сделало возможным напрямую печатать скаффолды из биоматериалов для использовании их в трансплантации, с подобранными клетками или без них. Следующей ступенью была 3D биопечать как метод инженерии тканей, что стало возможным благодаря последним достижениям в технологиях трехмерной печати, клеточной биологии и материаловедения. Другой родственной сферой применения 3D печати стало производство медицинских приборов, таких как стенты и шины для клинического использования. В 3D-биопечати для формирования трехмерных структур применяется аддитивное наращивание биологических материалов, биохимикатов и живых клеток послойно с контролем размещения функциональных компонентов в пространстве. Существует несколько подходов к 3D биопечати, в том числе биомимикрия, автономная самосборка и наращивание из тканевых «кирпичиков».
Подходы к 3D биопечати
Трехмерная биопечать основывается на трех основных подходах: биомимикрии, автономной самосборке и построении тканевых мини-блоков. Рассмотрим каждую из этих стратегий более детально.
Скорее всего, для печати мультифункциональной комплексной трехмерной структуры будет необходимо комбинировать вышеупомянутые стратегии. Главные этапы печати, общие для всех методов, таковы: создание образа и оформление, проектирование, выбор материалов и клеток, печать тканевой конструкции. Далее печатная конструкция трансплантируется (иногда после созревания invitro) или подвергается анализу в лабораторных условиях.
БИОМИМИКРИЯ
 Такой подход к 3D-биопечати подразумевает изготовление идентичных копий клеточных и внеклеточных компонентов ткани или органа. Этого можно достичь путем создания определённых клеточных компонентов ткани или биоматериалов, физиологически соответствующих данной ткани. Для того, чтобы достичь результатов при использовании данного метода, необходима репликация биологических тканей уже на микроскопическом уровне. Получение новых данных в этой сфере обусловливает необходимость различных исследований в области инженерии, биоматериалов, клеточной биологии, биофизики и медицины, что нужно для получения продуктивных результатов при использовании данного подхода.
Такой подход к 3D-биопечати подразумевает изготовление идентичных копий клеточных и внеклеточных компонентов ткани или органа. Этого можно достичь путем создания определённых клеточных компонентов ткани или биоматериалов, физиологически соответствующих данной ткани. Для того, чтобы достичь результатов при использовании данного метода, необходима репликация биологических тканей уже на микроскопическом уровне. Получение новых данных в этой сфере обусловливает необходимость различных исследований в области инженерии, биоматериалов, клеточной биологии, биофизики и медицины, что нужно для получения продуктивных результатов при использовании данного подхода.
АВТОНОМНАЯ САМОСБОРКА
Еще одним подходом к воспроизведению биологических тканей является использование стратегии развития органов в эмбриогенезе как базовой основы. «Бескаркасный» вариант этого подхода включает использование самособирающихся клеточных сфероидов, которые будут подвергаться расплавлению и клеточной реорганизации для воссоздания развивающихся тканей. Принцип автономной самосборки основывается на том утверждении, что клетка как основной стимулирующий фактор гистогенеза управляет структурной организацией, локализацией и основными свойствами ткани. Применение этого подхода требует глубоких знаний механизмов развития тканей в эмбриогенезе, а также разработки методов управления микроокружением ткани для регулирования механизмов клеточной дифференцировки в готовой печатной модели.
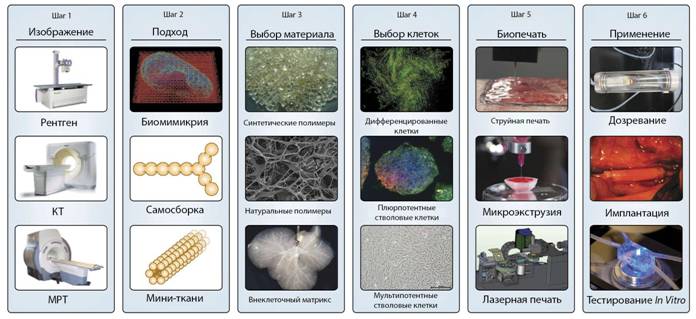
МИНИ-ТКАНИ
 Концепция мини-тканей уместна для обеих вышеупомянутых стратегих трехмерной биопечати. Органы и ткани будут состоять из небольших функционирующих блоков, так называемых «мини-тканей» — наименьших структурных и функциональных компонентов ткани. Мини-ткани могут быть объединены в конструкции большего размера как оптимальным предварительным размещением, так и без стороннего вмешательства. Не исключается и комбинация этих методов. Таким образом, существуют две основные стратегии. Первая – самособирающиеся клеточные сфероиды, которые будут объединены в ткани с помощью физиологичного размещения. Вторая – полученные тканевые единицы будут сами собираться в функционирующую ткань без каких-либо вмешательств извне. Практическим примером применения данных методов может быть самосборка сосудистых блоков при формировании ветвящегося васкулярного дерева.
Концепция мини-тканей уместна для обеих вышеупомянутых стратегих трехмерной биопечати. Органы и ткани будут состоять из небольших функционирующих блоков, так называемых «мини-тканей» — наименьших структурных и функциональных компонентов ткани. Мини-ткани могут быть объединены в конструкции большего размера как оптимальным предварительным размещением, так и без стороннего вмешательства. Не исключается и комбинация этих методов. Таким образом, существуют две основные стратегии. Первая – самособирающиеся клеточные сфероиды, которые будут объединены в ткани с помощью физиологичного размещения. Вторая – полученные тканевые единицы будут сами собираться в функционирующую ткань без каких-либо вмешательств извне. Практическим примером применения данных методов может быть самосборка сосудистых блоков при формировании ветвящегося васкулярного дерева.
Стратегии биопечати тканей
Главные технологии, которые используются для расположения и размещения биологического материала – это струйная, микроэкструзионная и лазерная печать. Различные свойства, характерные для этих технологий, должны быть учтены в соответствии с важнейшими факторами трёхмерной биопечати – поверхностное разрешение, выживаемость клеток в составе материалов и собственно биологические материалы, задействованные в печати.
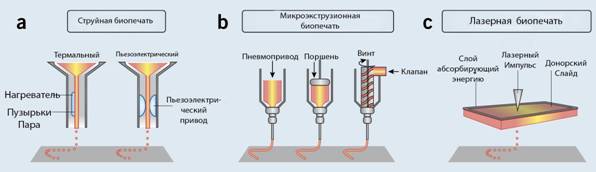
Струйная биопечать
Струйные принтеры – это наиболее распространённый тип принтеров, используемыхх в печати в целом и в биопечати в частности. Задаваемые программой количества жидкости подаются на определённые области. Первые принтеры, использовавшиеся для биопечати, представляли собой модифицированные версии обычных двухмерных струйных принтеров, запрвляемых тонером. Тонер в картриджах заменяли биологическим материалом, а бумагу – управляемым электроникой поддоном, контролировавшим положением печатающей головки в оси z.
В настоящий момент струйные биопринтеры специально приспособлены правильно хранить и распределять биологические материалы в большем разрешении, точнее и быстрее. Струйные принтеры используют акустические или термальные процессы для выброса капель жидкости (в случае двухмерного принтера – красителя) на субстрат (напр. бумага, уже отпечатанный материал или специальный поддон), который поддерживает и формирует конструкцию конечного продукта.
Термальные струйные принтеры действуют так. Микроскопический нагревательный элемент в сопле при прохождении электрического тока мгновенно нагревается и образует в жидкости газовые пузырьки, которые вытесняют жидкость из сопла. Несколько исследований показали, что это строго локализованное нагревание, достигающее двухсот-трёхсот градусов, не оказывает критического влияния на стабильности биологических молекул вроде дезоксирибонуклеиновой кислоты или на выживаемости или функциональной эффективности живых клеток после печати. К преимуществам термальной струйной печати относят высокую скорость печати, низкую стоимость и широкую доступность. Как бы то ни было, угроза экспозиции клеток и тканей грубому тепловому и механическому воздействию, относительно низкая точность выброса капель, их неравномерное распределение в калибрах, частая закупорка сопла и ненадёжная изоляция клеток дают понять о негативных сторонах этого способа печати.
Во многих струйных принтерах используется пьезоэлектрический кристалл, который создает звуковую волну внутри головки принтера для распыления жидкости на мелкие капли с определенной частотой. Под напряжением, пьезоэлектрический кристалл мгновенно меняет форму, создавая давление, необходимое для выбрасывания капель из сопла.
Еще один распространенный недостаток струйных биопринтеров заключается в том, что биологические материалы должны находиться в жидкой форме для образования капелек. Таким образом, перенесенная на бумагу жидкость затем должна сформировать 3D объект со структурной организацией и функциональностью. Наша команда и сторонние исследователи показали, что это ограничение может быть преодолено при использовании материалов, которые могут сшиваться между собой, после наложения, под воздействием химических факторов, кислотности или ультрафиолета. Однако факторы для сшивания обычно замедляют процесс биопечати и вовлекают химические модификации экстрацеллюлярного матрикса структуры, что изменяет его как химические, так и физические функции. К тому же, некоторые механизмы сшивания требуют присутствия токсических веществ или условий, опасных для клетки. Пользователи струйных биопринтеров столкнулись с еще одной проблемой — сложность достижения необходимой биологической плотности клеток. Обычно, низкие концентрации клеток (меньше 10 млн./мл) используются для облегчения образования капелек и для предотвращения закупорки сопла. Более высокие концентрации клеток могут также замедлять некоторые механизмы сшивания гидрогеля.
Несмотря на это, недостатки струйных биопринтеров перекрываются преимуществами, включающими низкую стоимость, высокую разрешающую способность, высокую скорость печати и совместимость со многими биологическим материалами. Еще одним преимуществом струйных биопринтеров является способность создавать градиент концентрации клеток, тканей или факторов роста по всей площади 3D структуры, посредством изменения размеров и плотности капель.
Отдельные образцы струйной биопечати подходят для регенерации полноценных кожных покровов и хрящей insitu. Высокая скорость печати дает возможность непосредственного наложения клеток и материалов на кожу или поврежденный хрящ.