Алюминий. Химия алюминия и его соединений

1. Положение алюминия в периодической системе химических элементов
2. Электронное строение алюминия
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой
7.1.3. Взаимодействие с фосфором
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с углеродом
7.1.6. Горение
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с водой
7.2.2. Взаимодействие с минеральными кислотами
7.2.3. Взаимодействие с серной кислотой
7.2.4. Взаимодействие с азотной кислотой
7.2.5. Взаимодействие с щелочами
7.2.6. Взаимодействие с окислителями
Оксид алюминия
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с основными оксидами
2.2. Взаимодействие с основаниями
2.3. Взаимодействие с водой
2.4. Взаимодействие с кислотными оксидами
2.5. Взаимодействие с кислотами
2.6. Взаимодействие с восстановителями
2.7. Вытеснение более летучих оксидов из солей
Гидроксид алюминия
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с кислотами
2.2. Взаимодействие с кислотными оксидами
2.3. Взаимодействие с щелочами
2.4. Разложение при нагревании
Соли алюминия
Бинарные соединения алюминия
Алюминий
Положение в периодической системе химических элементов
Алюминий расположены в главной подгруппе III группы (или в 13 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение алюминия и свойства
Электронная конфигурация алюминия в основном состоянии:
+13Al 1s22s 2 2p 6 3s 2 3p 1 1s 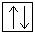 2s
2s  2p
2p 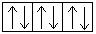 3s
3s  3p
3p 
|
|
Электронная конфигурация алюминия в возбужденном состоянии:
+13Al * 1s22s 2 2p 6 3s 1 3p 2 1s  2s
2s  2p
2p  3s
3s  3p
3p 
Алюминий проявляет парамагнитные свойства. Алюминий на воздухе быстро образует прочные оксидные плёнки, защищающие поверхность от дальнейшего взаимодействия, поэтому устойчив к коррозии.
Физические свойства
Алюминий – лёгкий металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Обладает высокой тепло- и электропроводностью.

Температура плавления 660оС, температура кипения 1450оС, плотность алюминия 2,7 г/см3.
Нахождение в природе
Алюминий — самый распространенный металл в природе, и 3-й по распространенности среди всех элементов (после кислорода и кремния). Содержание в земной коре — около 8%.
В природе алюминий встречается в виде соединений:
Бокситы Al 2 O 3 · H 2 O (с примесями SiO 2, Fe 2 O 3, CaCO 3 ) — гидрат оксида алюминия.

Корунд Al 2 O 3.Красный корунд называют рубином, синий корунд называют сапфиром.

Способы получения
Алюминий образует прочную химическую связь с кислородом. Поэтому традиционные способы получения алюминия восстановлением из оксида протекают требуют больших затрат энергии. Для промышленного получения алюминия используют процесс Холла-Эру. Для понижения температуры плавления оксид алюминия растворяют в расплавленном криолите (при температуре 960-970оС) Na3AlF6, а затем подвергают электролизу с углеродными электродами. При растворении в расплаве криолита оксид алюминия распадается на ионы:
Al 2 O 3 → Al 3+ + AlO 33-
|
|
На катоде происходит восстановление ионов алюминия:
Катод: Al 3+ +3e → Al 0
На аноде происходит окисление алюминат-ионов:
Анод: 4AlO 33- — 12e → 2Al 2 O 3 + 3O 2
Суммарное уравнение электролиза расплава оксида алюминия:
2Al 2 O 3 → 4Al + 3O 2
Лабораторный способ получения алюминия заключается в восстановлении алюминия из безводного хлорида алюминия металлическим калием:
AlCl 3 + 3K → 4Al + 3KCl
Качественные реакции
Качественная реакция на ионы алюминия — взаимодействие избытка солей алюминия с щелочами. При этом образуется белый аморфный осадок гидроксида алюминия.
Например, хлорид алюминия взаимодействует с гидроксидом натрия:
AlCl 3 + 3NaOH → Al(OH) 3 + 3NaCl

При дальнейшем добавлении щелочи амфотерный гидроксид алюминия растворяется с образованием тетрагидроксоалюмината: 
Al(OH) 3 + NaOH = Na[Al(OH) 4 ]
Обратите внимание, если мы поместим соль алюминия в избыток раствора щелочи, то белый осадок гидроксида алюминия не образуется, т.к. в избытке щелочи соединения алюминия сразу переходят в комплекс:
AlCl 3 + 4NaOH = Na[Al(OH) 4 ] + 3NaCl
Соли алюминия можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей алюминия с водным раствором аммиака также выпадает полупрозрачный студенистый осадок гидроксида алюминия.
AlCl 3 + 3NH 3 ·H 2 O = Al(OH) 3 ↓ + 3NH 4 Cl
Al 3+ + 3NH 3 ·H 2 O = Al(OH) 3 ↓ + 3NH 4+
Химические свойства
1. Алюминий – сильный восстановитель. Поэтому он реагирует со многими неметаллами.
1.1. Алюминий реагируют с галогенами с образованием галогенидов:
2Al + 3I 2 → 2AlI 3
1.2. Алюминий реагирует с серой с образованием сульфидов:
|
|
2Al + 3S → Al 2 S 3
1.3. Алюминий реагируют с фосфором. При этом образуются бинарные соединения — фосфиды:
Al + P → AlP
1.4. С азотом алюминий реагирует при нагревании до 1000оС с образованием нитрида:
2Al +N 2 → 2AlN
1.5. Алюминий реагирует с углеродом с образованием карбида алюминия:
4Al + 3C → Al 4 C 3
1.6. Алюминий взаимодействует с кислородом с образованием оксида:
4Al + 3O 2 → 2Al 2 O 3
2. Алюминий взаимодействует со сложными веществами:
2.1. Реагирует ли алюминий с водой? Ответ на этот вопрос вы без труда найдете, если покопаетесь немного в своей памяти. Наверняка хотя бы раз в жизни вы встречались с алюминиевыми кастрюлями или алюминиевыми столовыми приборами. Такой вопрос я любила задавать студентам на экзаменах. Что самое удивительное, ответы я получала разные — у кого-то алюминий таки реагировал с водой. И очень, очень многие сдавались после вопроса: «Может быть, алюминий реагирует с водой при нагревании?» При нагревании алюминий реагировал с водой уже у половины респондентов))
Тем не менее, несложно понять, что алюминий все-таки с водой в обычных условиях (да и при нагревании) не взаимодействует. И мы уже упоминали, почему:из-за образования оксидной пленки. А вот если алюминий очистить от оксидной пленки (например, амальгамировать), то он будет взаимодействовать с водой очень активно с образованием гидроксида алюминия и водорода:
2Al 0 + 6H 2+ O → 2Al +3 (OH) 3 + 3H 20

Амальгаму алюминия можно получить, выдержав кусочки алюминия в растворе хлорида ртути (II):
3HgCl 2 + 2Al → 2AlCl 3 + 3Hg

2.2. Алюминий взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль и водород.
Например, алюминий бурно реагирует с соляной кислотой:
2Al + 6HCl = 2AlCl 3 + 3H 2 ↑

2.3. При обычных условиях алюминий не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат алюминия и вода:
2Al + 6H 2 SO 4(конц.) → Al 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O
2.4. Алюминий не реагирует с концентрированной азотной кислотой также из-за пассивации.
С разбавленной азотной кислотой алюминий реагирует с образованием молекулярного азота:
10Al + 36HNO 3 (разб) → 3N 2 + 10Al(NO 3 ) 3 + 18H 2 O
При взаимодействии алюминия в виде порошка с очень разбавленной азотной кислотой может образоваться нитрат аммония:
8Al + 30HNO 3(оч.разб.) → 8Al(NO 3 ) 3 + 3NH 4 NO 3 + 9H 2 O
2.5. Алюминий – амфотерный металл, поэтому он взаимодействует с щелочами. При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
2Al + 2NaOH + 6H 2 O → 2Na[Al(OH) 4 ] + 3H 2 ↑
Алюминий реагирует с расплавом щелочи с образованием алюмината и водорода:
2Al + 6NaOH → 2Na 3 AlO 3 + 3H 2 ↑
Эту же реакцию можно записать в другом виде (в ЕГЭ рекомендую записывать реакцию именно в таком виде):
2Al + 6NaOH → NaAlO 2 + 3H 2 ↑ + Na 2 O
2.6. Алюминий восстанавливает менее активные металлы из оксидов. Процесс восстановления металлов из оксидов называется алюмотермия.
Например, алюминий вытесняет медь из оксида меди (II). Реакция очень экзотермическая:
2Al + 3CuO → 3Cu + Al 2 O 3
Еще пример: алюминий восстанавливает железо из железной окалины, оксида железа (II, III):
8Al + 3Fe 3 O 4 → 4Al 2 O 3 + 9Fe
Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами в щелочной среде, перманганатами, соединениями хрома (VI):
2Al + 3Na 2 O 2 → 2NaAlO 2 + 2Na 2 O
8Al + 3KNO 3 + 5KOH + 18H 2 O → 8K[Al(OH) 4 ] + 3NH 3
10Al + 6KMnO 4 + 24H 2 SO 4 → 5Al 2 (SO 4 ) 3 + 6MnSO 4 + 3K 2 SO 4 + 24H 2 O
2Al + NaNO 2 + NaOH + 5H 2 O → 2Na[Al(OH) 4 ] + NH 3
Al + 3KMnO 4 + 4KOH → 3K 2 MnO 4 + K[Al(OH) 4 ]
4Al + K 2 Cr 2 O 7 → 2Cr + 2KAlO 2 + Al 2 O 3
Оксидалюминия
Способы получения
Оксид алюминия можно получить различными методами:
1. Горением алюминия на воздухе:
4Al + 3O 2 → 2Al 2 O 3
2. Разложением гидроксида алюминия при нагревании:
2Al(OH) 3 → Al 2 O 3 + 3H 2 O
3. Оксид алюминия можно получить разложением нитрата алюминия:
4Al(NO 3 ) 3 → 2Al 2 O 3 + 12NO 2 + 3O 2
Химические свойства
Оксид алюминия — типичный амфотерный оксид. Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида алюминия с основными оксидами образуются соли- алюминаты.
Например, оксид алюминиявзаимодействует с оксидом натрия:
Na 2 O + Al 2 O 3 → 2NaAlO2
2. Оксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли — алюминаты, а в растворе – комплексные соли. При этом оксид алюминия проявляет кислотные свойства.
Например, оксид алюминиявзаимодействует с гидроксидом натрия в расплаве с образованием алюмината натрия и воды:
2NaOH + Al 2 O 3 → 2NaAlO 2 + H 2 O
Оксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
Al 2 O 3 + 2NaOH + 3H 2 O → 2Na[Al(OH) 4 ]
3. Оксид алюминия не взаимодействует с водой.
4. Оксид алюминия взаимодействуетс кислотными оксидами (сильных кислот). При этом образуются соли алюминия. При этом оксид алюминия проявляет основные свойства.
Например, оксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
Al 2 O 3 + 3SO 3 → Al 2 (SO 4 ) 3
5. Оксид алюминия взаимодействует с растворимыми кислотами с образованием средних и кислых солей.
Например, оксид алюминия реагирует с серной кислотой:
Al 2 O 3 + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 O
6. Оксид алюминия проявляет слабые окислительные свойства.
Например, оксид алюминия реагирует с гидридом кальция с образованием алюминия, водорода и оксида кальция:
Al 2 O 3 + 3CaH 2 → 3CaO + 2Al + 3H 2
Электрический ток восстанавливает алюминий из оксида (производство алюминия):
2Al 2 O 3 → 4Al + 3O 2
7. Оксид алюминия — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната натрия:
Al 2 O 3 + Na 2 CO 3 → 2NaAlO 2 + CO2
Гидроксид алюминия
Способы получения
1. Гидроксид алюминия можно получить действием раствора аммиака на соли алюминия.
Например, хлорид алюминия реагирует с водным раствором аммиака с образованием гидроксида алюминия и хлорида аммония:
AlCl 3 + 3NH 3 + 3H 2 O = Al(OH) 3 + 3NH 4 Cl
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоалюмината натрия:
Na[Al(OH) 4 ] + СО 2 = Al(OH) 3 + NaНCO 3
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество Na[Al(OH) 4 ] на составные части: NaOH и Al(OH) 3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Al(OH) 3 не реагирует с СО 2, то мы записываем справа Al(OH) 3 без изменения.
3. Гидроксид алюминия можно получить действием недостатка щелочи на избыток соли алюминия.
Например, хлорид алюминия реагирует с недостатком гидроксида калия с образованием гидроксида алюминия и хлорида калия:
AlCl 3 + 3KOH (недост) = Al(OH) 3 ↓+ 3KCl
4. Также гидроксид алюминия образуется при взаимодействии растворимых солей алюминия с растворимыми карбонатами, сульфитами и сульфидами. Сульфиды, карбонаты и сульфиты алюминия необратимо гидролизуются в водном растворе.
Например: бромид алюминия реагирует с карбонатом натрия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется бромид натрия:
2AlBr 3 + 3Na 2 CO 3 + 3H 2 O = 2Al(OH) 3 ↓ + CO 2 ↑ + 6NaBr
Хлорид алюминия реагирует с сульфидом натрия с образованием гидроксида алюминия, сероводорода и хлорида натрия:
2AlCl 3 + 3Na 2 S + 6H 2 O = 2Al(OH) 3 + 3H 2 S↑ + 6NaCl
Химические свойства
1. Гидроксид алюминия реагирует с растворимыми кислотами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов и типа соли.
Например, гидроксид алюминия взаимодействует с азотной кислотой с образованием нитрата алюминия:
Al(OH) 3 + 3HNO 3 → Al(NO 3 ) 3 + 3H 2 O
Al(OH) 3 + 3HCl → AlCl 3 + 3H 2 O
2Al(OH) 3 + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 6H 2 O
Al(OH) 3 + 3HBr → AlBr 3 + 3H 2 O
2. Гидроксид алюминия взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
2Al(OH) 3 + 3SO 3 → Al 2 (SO 4 ) 3 + 3H 2 O
3. Гидроксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли — алюминаты, а в растворе – комплексные соли. При этом гидроксид алюминия проявляет кислотные свойства.
Например, гидроксид алюминиявзаимодействует с гидроксидом калия в расплаве с образованием алюмината калия и воды:
2KOH + Al(OH) 3 → 2KAlO 2 + 2H 2 O
Гидроксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
Al(OH) 3 + KOH → K[Al(OH) 4 ]
4. Гидроксид алюминия разлагается при нагревании:
2Al(OH) 3 → Al 2 O 3 + 3H 2 O
Соли алюминия
Нитрат и сульфат алюминия
Нитрат алюминия при нагревании разлагается на оксид алюминия, оксид азота (IV) и кислород:
4Al(NO 3 ) 3 → 2Al 2 O 3 + 12NO 2 + 3O 2
Сульфат алюминия при сильном нагревании разлагается аналогично — на оксид алюминия, сернистый газ и кислород:
2Al 2 (SO 4 ) 3 → 2Al 2 O 3 + 6SO 2 + 3O 2